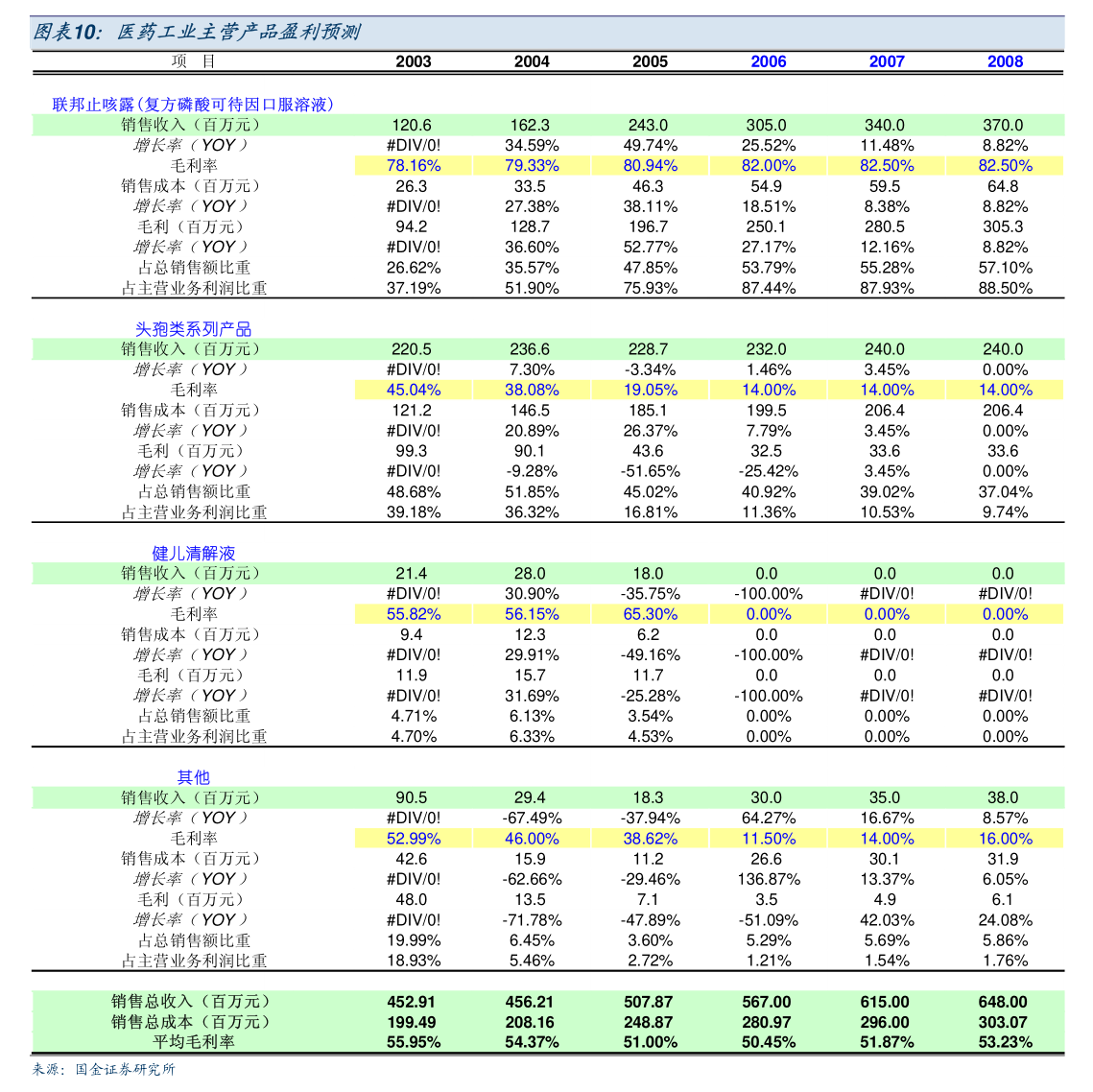
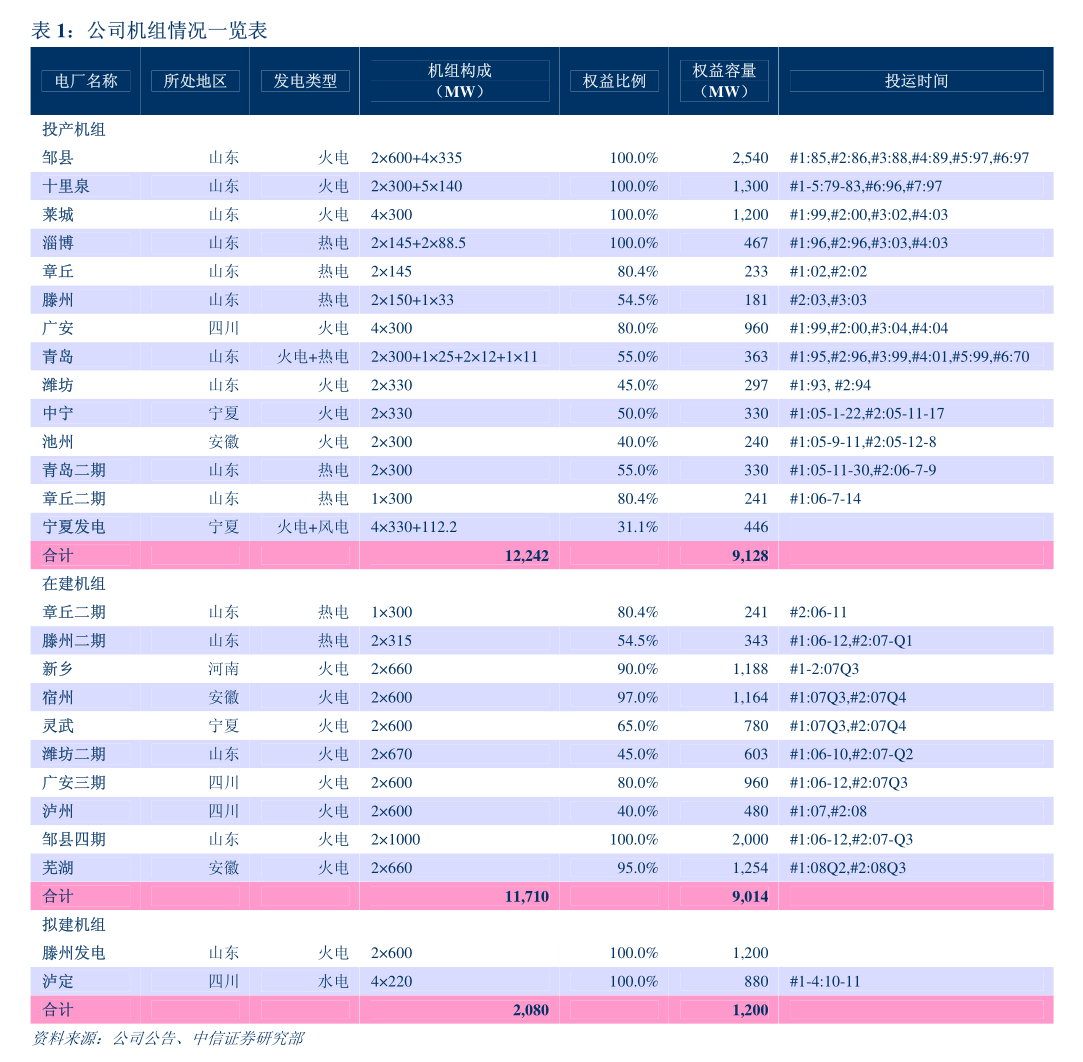
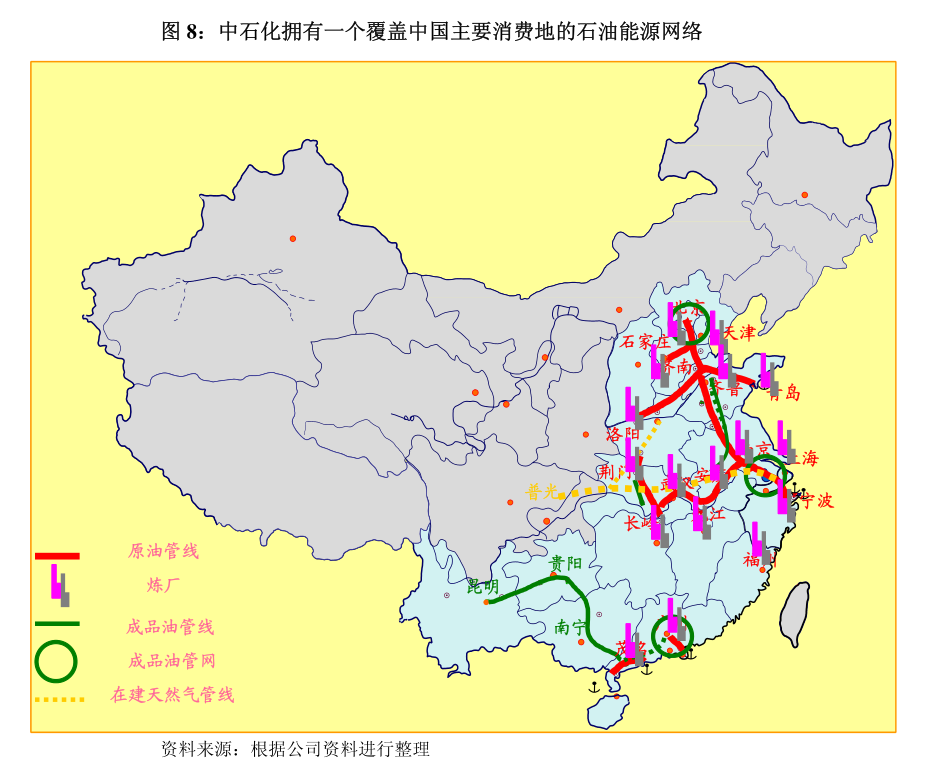
主要行业
点击进入可选择细分行业
1. 1香港交易及結算所有限公司及香港聯合交易所有限公司對本公告的內容概不負責,對其準確性或完整性亦不發表任何聲明,並明確表示,概不對因本公告全部或任何部份內容而產生或因倚賴該等內容而引致的任何損失承擔任何責任。
2. (於開曼群島註冊成立之有限公司)網站:(股份編號:1177)自願公告貝莫蘇拜單抗注射液聯合鹽酸安羅替尼膠囊用於晚期腎細胞癌一線治療III期研究取得陽性結果中國生物製藥有限公司(「本公司」,連同其附屬公司統稱「本集團」)董事會(「董事會」)宣佈,本集團自主研發的1類創新藥貝莫蘇拜單抗注射液「Benmelstobart(TQB2450)」聯合1類創新藥鹽酸安羅替尼膠囊用於晚期不可切除或轉移性腎細胞癌(RCC)一線治療的隨機、開放、陽性藥物平行對照、多中心III期臨床研究(ETER100研究)已完成方案預設的期中分析,獨立數據監查委員會(IDMC)判定主要研究終點無進展生存期(PFS,基於獨立影像評估)達到方案預設的優效界值,且次要終點總生存期(OS)顯示獲益趨勢。
3. 本集團已與中國國家藥品監督管理局藥品審評中心(CDE)就該適應症的上市申請進行溝通,並獲得CDE同意提交貝莫蘇拜單抗注射液聯合鹽酸安羅替尼膠囊新增該適應症的上市申請。
4. 本集團將於近期遞交上市申請。
5. 2腎癌是全球泌尿系統第三位最常見的惡性腫瘤,而RCC佔全部腎癌病例的80%-90%1。

6. 據統計,2022年中國腎癌新發病例和死亡病例分別約為7.7萬例和4.6萬例2。
7. 約三分之一的腎癌患者在初診時已發生腫瘤遠處轉移,而局限性患者接受腎切除術後仍有20%-50%出現腫瘤遠處轉移3,4。
8. 基於國際轉移性腎細胞癌數據庫聯盟的風險分級,低危、中危和高危的轉移性RCC患者接受抗血管靶向治療的中位總生存期(OS)分別為35.3、16.6和5.4個月1,5。
9. 近年來,海外已有PD-(L)1抑制劑聯合抗血管靶向藥物在晚期RCC一線治療上取得成功,取代抗血管靶向藥物單藥治療成為新的晚期RCC標準一線治療方案6。
10. 相較於抗血管靶向藥物單藥,PD-(L)1單抗聯合抗血管靶向藥物治療能夠顯著延長患者的PFS,提高客觀緩解率(ORR),並可觀察到OS的明顯獲益。
11. 作為國內首個雙國產創新藥組合用於晚期腎癌免疫治療關鍵III期研究,ETER100研究(NCT04523272)是一項隨機、開放、陽性藥物平行對照、多中心III期臨床研究,旨在評估貝莫蘇拜單抗注射液聯合鹽酸安羅替尼膠囊對比蘋果酸舒尼替尼膠囊一線治療晚期不可切除或轉移性RCC的有效性和安全性。

12. 根據本研究的期中分析結果,相較於舒尼替尼,貝莫蘇拜聯合鹽酸安羅替尼膠囊一線治療晚期RCC可顯著降低患者的疾病進展或死亡風險,同時改善ORR、OS等次要終點。
13. 貝莫蘇拜單抗注射液安全性數據與已知風險相符,未發現新的安全性信號。
14. 關於詳細的研究數據,本集團將在近期國際學術大會上公佈。

15. 貝莫蘇拜單抗注射液聯合鹽酸安羅替尼膠囊將為廣大晚期腎癌患者帶來新的治療希望,解決尚未被滿足的臨床需求,造福國內患者。
16. 同時,也標誌著貝莫蘇拜單抗注射液在小細胞肺癌、子宮內膜癌領域之後,成功佈局了又一個重要領域。
一線晚期腎細胞癌將是貝莫蘇拜單抗注射液申報的第三個適應症,鹽酸安羅替尼膠囊申報的第八個適應症。

此外,貝莫蘇拜單抗注射液聯合鹽酸安羅替尼膠囊正在開展多項臨床III期試驗,包括一線非小細胞肺癌、非小細胞肺癌放化療後維持等,本集團將持續推進貝莫蘇拜單抗注射液和鹽酸安羅替尼膠囊的開發,為更多患者帶來新的治療方案。
隨著本集團在創新研發中的不斷投入,創新產品取得不斷突破,創新管線已進入收穫期。
3資料來源:[1]中華人民共和國國家衛生健康委員會.《腎細胞癌診療指南(2022年版)》.2022.[2]XiaC,DongX,LiH,etal.CancerstatisticsinChinaandUnitedStates,2022:profiles,trends,anddeterminants.ChinMedJ(Engl)2022;135:584-90.[3]PadalaSA,BarsoukA,ThandraKC,etal.EpidemiologyofRenalCellCarcinoma.WorldJOncol2020;11:79-87.[4]JanzenNK,KimHL,FiglinRA,BelldegrunAS.Surveillanceafterradicalorpartialnephrectomyforlocalizedrenalcellcarcinomaandmanagementofrecurrentdisease.UrolClinNorthAm2003;30:843-52.[5]HengDY,XieW,ReganMM,etal.Prognosticfactorsforoverallsurvivalinpatientswithmetastaticrenalcellcarcinomatreatedwithvascularendothelialgrowthfactor-targetedagents:resultsfromalarge,multicenterstudy.JClinOncol2009;27:5794-9.[6]XuW,AtkinsMB,McDermottDF.Checkpointinhibitorimmunotherapyinkidneycancer.NatRevUrol2020;17:137-50.承董事會命中國生物製藥有限公司主席謝其潤香港,2024年5月23日於本公告日期,本公司董事會包括七位執行董事,即謝其潤女士、謝炳先生、鄭翔玲女士、謝承潤先生、謝炘先生、田舟山先生及李名沁女士,以及五位獨立非執行董事,即陸正飛先生、李大魁先生、魯紅女士、張魯夫先生及李國棟醫生。

正在加载,请稍候...