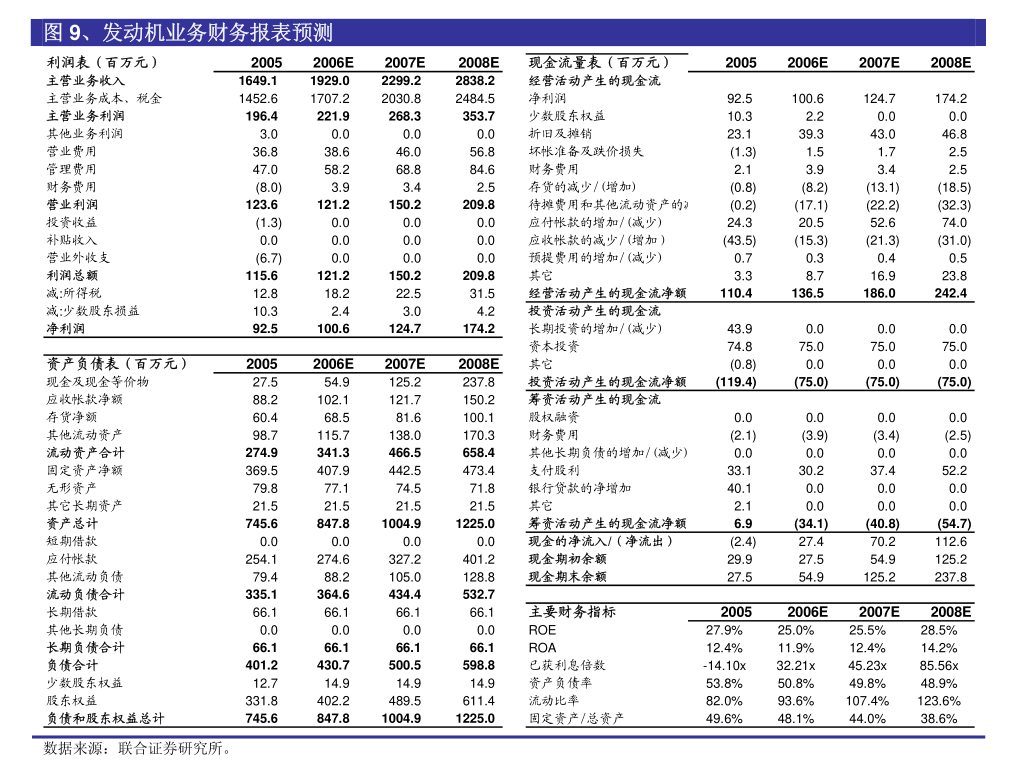
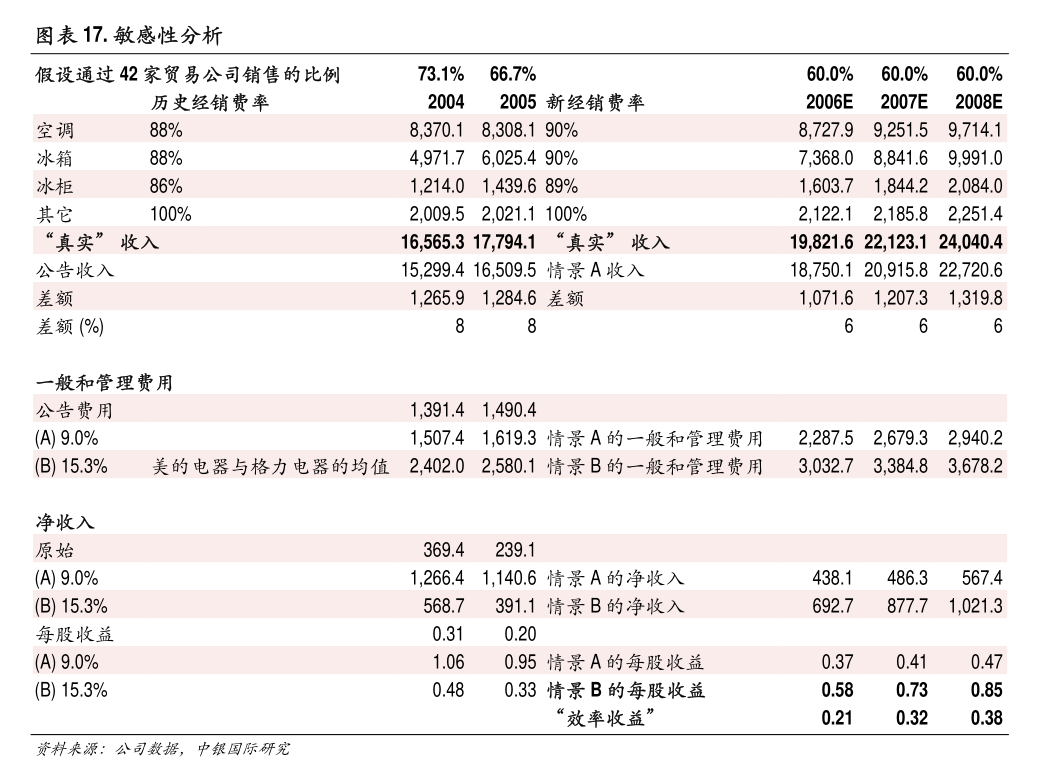
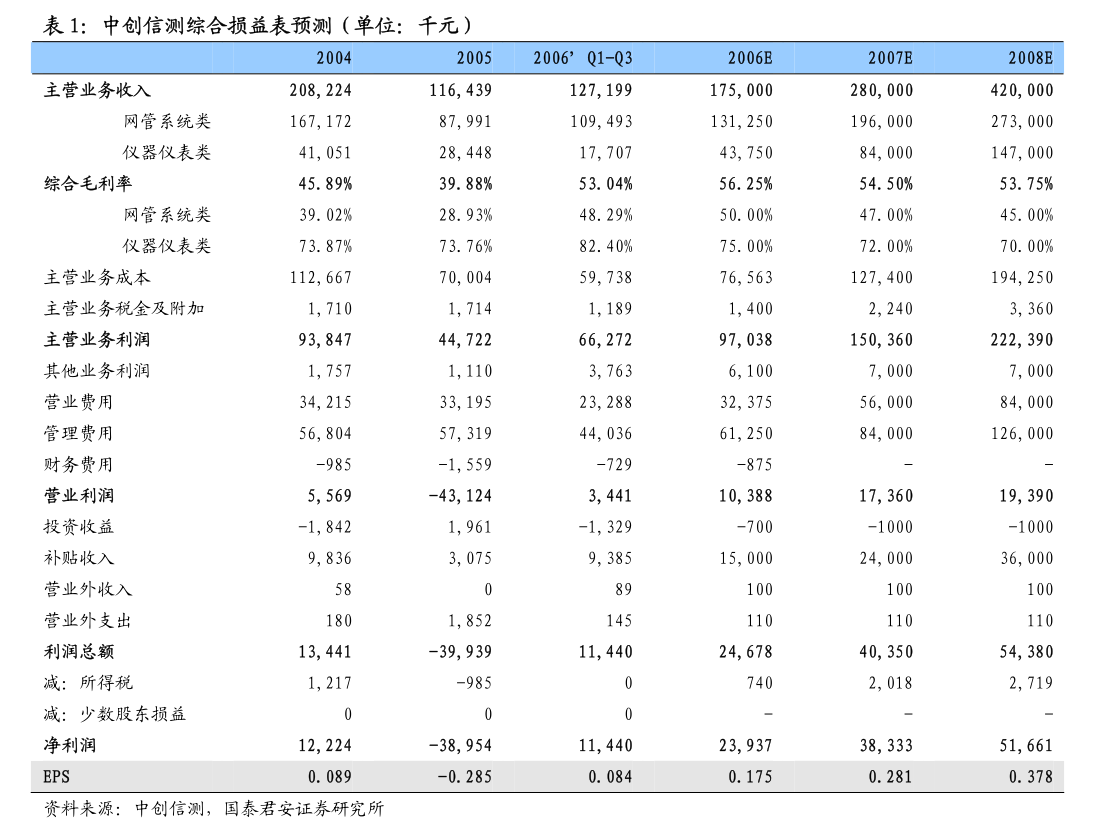
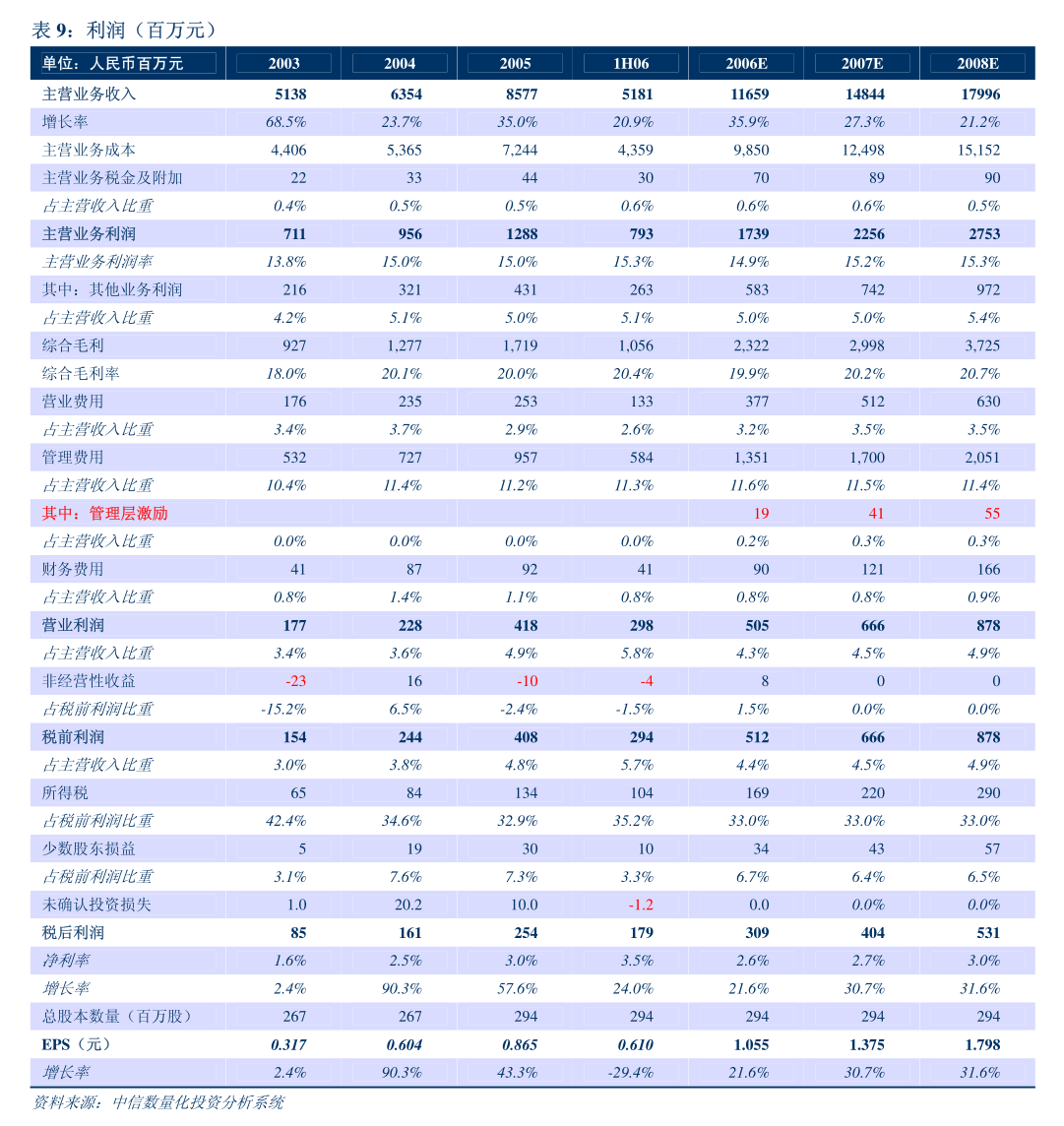
主要行业
点击进入可选择细分行业
1. 1香港交易及結算所有限公司及香港聯合交易所有限公司對本公告的內容概不負責,對其準確性或完整性亦不發表任何聲明,並明確表示,概不對因本公告全部或任何部份內容而產生或因倚賴該等內容而引致的任何損失承擔任何責任。
2. (於開曼群島註冊成立之有限公司)網站:(股份編號:1177)自願公告KRASG12C抑制劑「GARSORASIB(D-1553片)」II期臨床研究結果發表於《柳葉刀-呼吸病學》中國生物製藥有限公司(「本公司」,連同其附屬公司統稱「本集團」)董事會(「董事會」)宣佈,本集團聯合開發的KRASG12C抑制劑「garsorasib(D-1553片)」的II期註冊臨床研究結果已發表於國際著名期刊《柳葉刀-呼吸病學》(TheLancetRespiratoryMedicine,IF:76.2)。
3. 這是國產KRASG12C抑制劑首次登上《柳葉刀》系列雜誌。
4. 研究方法本次刊登在《柳葉刀-呼吸病學》的研究是一項在中國進行的開放標籤、多中心、II期單臂註冊研究(NCT05383898),旨在評估garsorasib在KRASG12C突變的局部晚期或轉移性非小細胞肺癌(NSCLC)患者中的有效性和安全性。
5. 主要入選標準有:KRASG12C突變的局部晚期或轉移性NSCLC患者;既往經抗PD-(L)1治療和含鉑化療後疾病進展或因毒性不耐受上述治療;並根據RECISTv1.1標準具有可測量病灶。
6. 主要終點是由盲態獨立審查委員會(IRC)根據RECISTv1.1評估的客觀緩解率(ORR)。

7. 次要終點包括緩解持續時間(DOR)、疾病控制率(DCR)、至緩解時間(TTR)、無進展生存期(PFS)、總生存期(OS),安全性和群體藥代動力學。
8. 2研究結果截至2023年11月17日,共有123例患者入組並接受garsorasib600mg一日兩次(BID)治療。
9. 其中,108例患者(88%)為男性,患者中位年齡為64歲(四分位距:59-68),ECOGPS評分為0和1的患者分別占11%和89%。
10. 截至數據截止日,82例(67%)患者終止了治療。
11. 中位隨訪時間為7.9個月(四分位距:6.3-10.4)。
12. 在療效方面,1例患者完全緩解,60例患者部分緩解,48例患者疾病穩定。
13. IRC確認的ORR為50%(61/123,95%CI,41-59),DCR為89%(109/123,95%CI,82-94)。
14. 中位DOR為12.8個月(95%CI,6.2-NE)。

15. 中位PFS為7.6個月(95%CI,5.6-9.7),中位OS尚未達到。
16. 在安全性方面,共有117例(95%)患者報告了治療相關不良事件(TRAE),其中61例(50%)患者出現了3級或以上的不良事件。
最常報告(≥20%)的TRAE(任何級別)為天門冬氨酸氨基轉移酶升高、丙氨酸氨基轉移酶升高、γ-谷氨酰轉移酶升高、貧血、血膽紅素升高、血鹼性磷酸酶升高、嘔吐和噁心。
分別有37例(30%)、51例(41%)患者因TRAE導致劑量減少、劑量中斷。
沒有患者因TRAE停止治療。
未發現新的安全性信號,大多數不良事件都得到了很好的控制。
研究結論在攜帶KRASG12C突變的NSCLC患者中,garsorasib顯示出較高的腫瘤緩解率和較長的緩解持續時間(ORR:50%,DCR:89%,中位DOR:12.8個月,中位PFS:7.6個月),以及良好的耐受性和可控性。
關於garsorasibGarsorasib是國內首個自主研發並進入臨床試驗階段的KRASG12C抑制劑,也是首個被中國國家藥品監督管理局藥品審評中心(CDE)納入突破性治療品種的國產KRASG12C抑制劑。

2023年12月,garsorasib用於既往經一線系統治療後疾病進展或不可耐受的、並且經檢測確認存在KRASG12C突變的局部晚期或轉移性NSCLC治療的新藥上市申請獲得受理,並於2024年1月被納入優先審評審批程序。
目前,D-1553單藥和聯合用藥在NSCLC一線治療以及結直腸癌等其他實體腫瘤中的國際多中心臨床研究正在進行中,部分研究結果已陸續發表於極具影響力的國際學術會議平台,均展示出了其良好的安全性和抗腫瘤活性。
32023年8月,本公司附屬公司正大天晴藥業集團股份有限公司(「正大天晴」)與益方生物科技(上海)股份有限公司(「益方生物」)簽署獨家許可與合作協議。
正大天晴獲益方生物授予garsorasib在中國大陸地區開發、註冊、生產和商業化的獨家許可權。
同時,基於未來潛在的數據分享合作,正大天晴將適時被授予一定比例的中國大陸以外地區收益。
承董事會命中國生物製藥有限公司主席謝其潤香港,2024年6月11日於本公告日期,本公司董事會包括六位執行董事,即謝其潤女士、謝炳先生、鄭翔玲女士、謝承潤先生、謝炘先生及田舟山先生,以及五位獨立非執行董事,即陸正飛先生、李大魁先生、魯紅女士、張魯夫先生及李國棟醫生。

正在加载,请稍候...