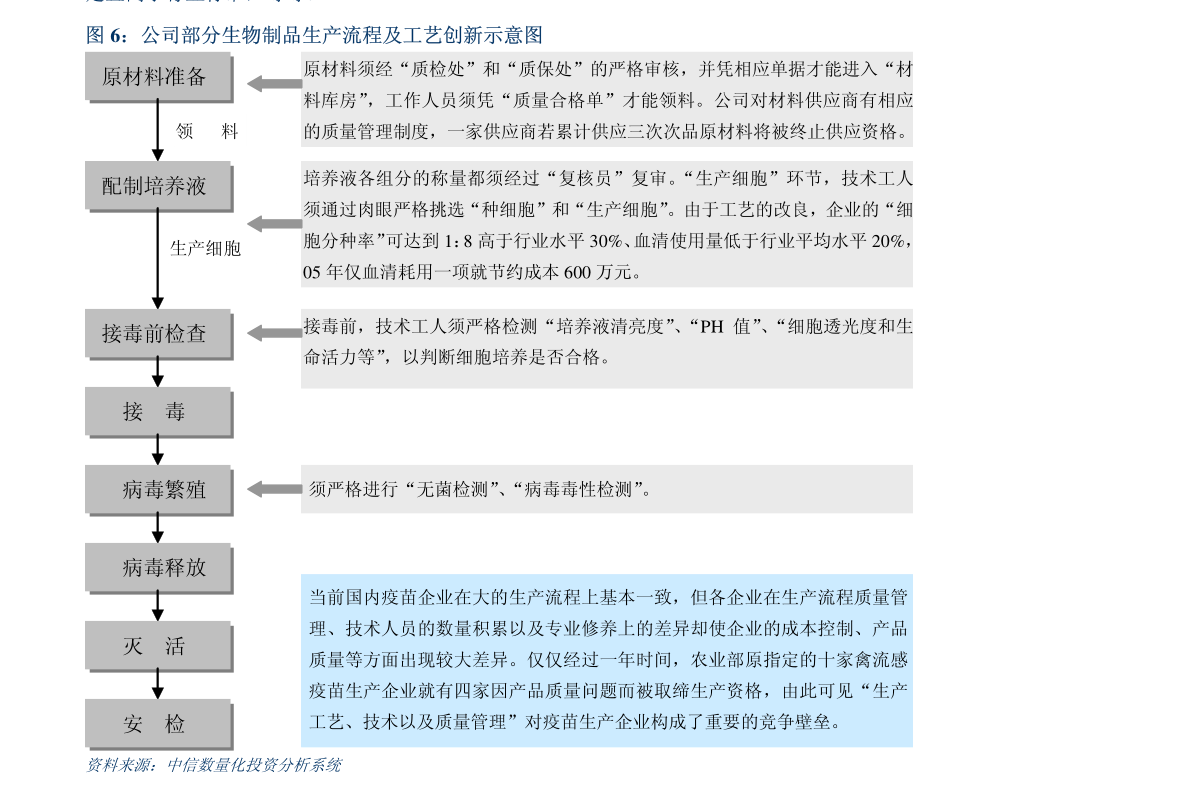
1. 证券代码:600276证券简称:恒瑞医药公告编号:临2023-015江苏恒瑞医药股份有限公司关于子公司药物上市许可申请获受理的提示性公告本公司董事会及全体董事保证本公告内容不存在任何虚假记载、误导性陈述或者重大遗漏,并对其内容的真实性、准确性和完整性承担法律责任。
2. 近日,江苏恒瑞医药股份有限公司(以下简称“公司”)子公司成都盛迪医药有限公司收到国家药品监督管理局(以下简称“国家药监局”)下发的《受理通知书》,公司提交SHR8058滴眼液的药品上市许可申请获国家药监局受理。
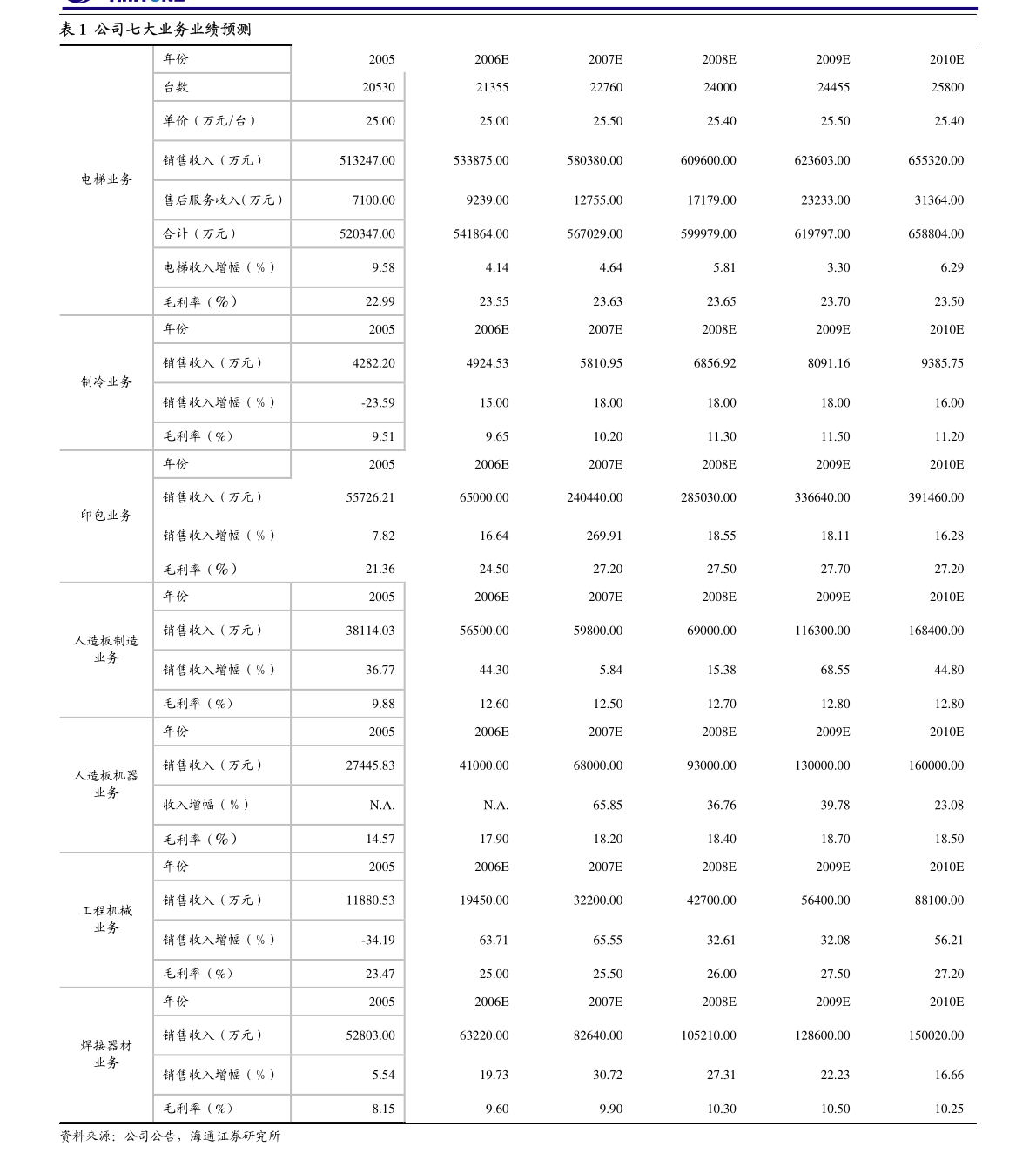
3. 现将相关情况公告如下:一、药物的基本情况药物名称:SHR8058滴眼液剂型:眼用制剂受理号:CXHS2300021申报阶段:上市申请人:成都盛迪医药有限公司拟定适应症(或功能主治):本品用于治疗睑板腺功能障碍相关干眼病。
4. 二、药物的临床试验情况2021年11月,SHR8058滴眼液Ⅲ期临床试验(SHR8058-301)主要研究终点结果达到方案预设的优效标准。
5. SHR8058-301研究是一项评价SHR8058滴眼液治疗睑板腺功能障碍相关干眼病的有效性和安全性的多中心、随机、双盲、盐溶液平行对照Ⅲ期临床试验,由首都医科大学附属北京同仁医院接英教授担任主要研究者,全国17家中心共同参与。
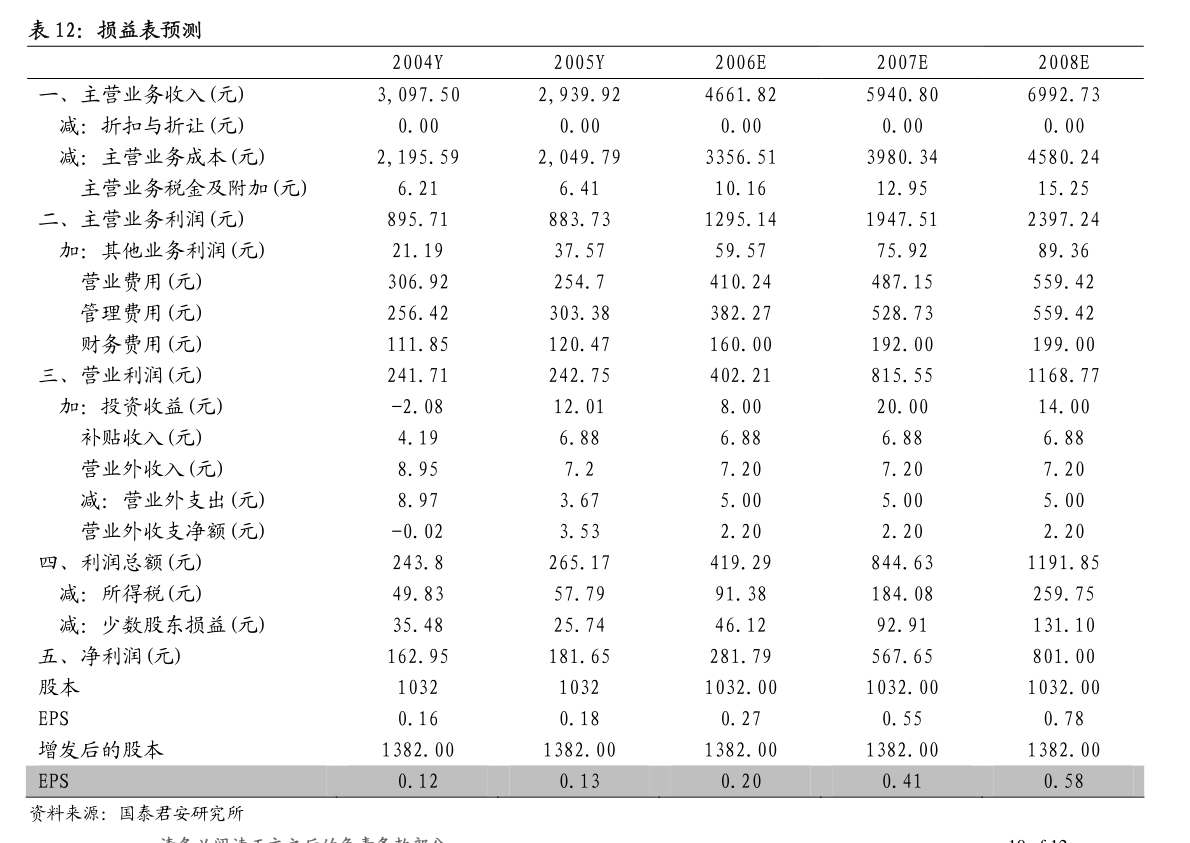
6. 主要研究终点是:1.治疗结束时(第57天)全角膜荧光素染色评分(tCFS)较基线的变化;2.治疗结束时(第57天)眼干的严重程度评分(VAS)较基线的变化。
7. 次要研究终点包括不同访视点全角膜染色评分、各个分区角膜染色评分、干眼视觉模拟量表(VAS)和OSDI问卷的各项评分及其较基线的变化和安全性等。
8. 本研究共入组312例睑板腺功能障碍相关干眼病的受试者,按照1:1随机入组,分别接受SHR8058滴眼液或安慰剂(0.6%盐溶液)治疗,双眼点药,一日四次,治疗8周。
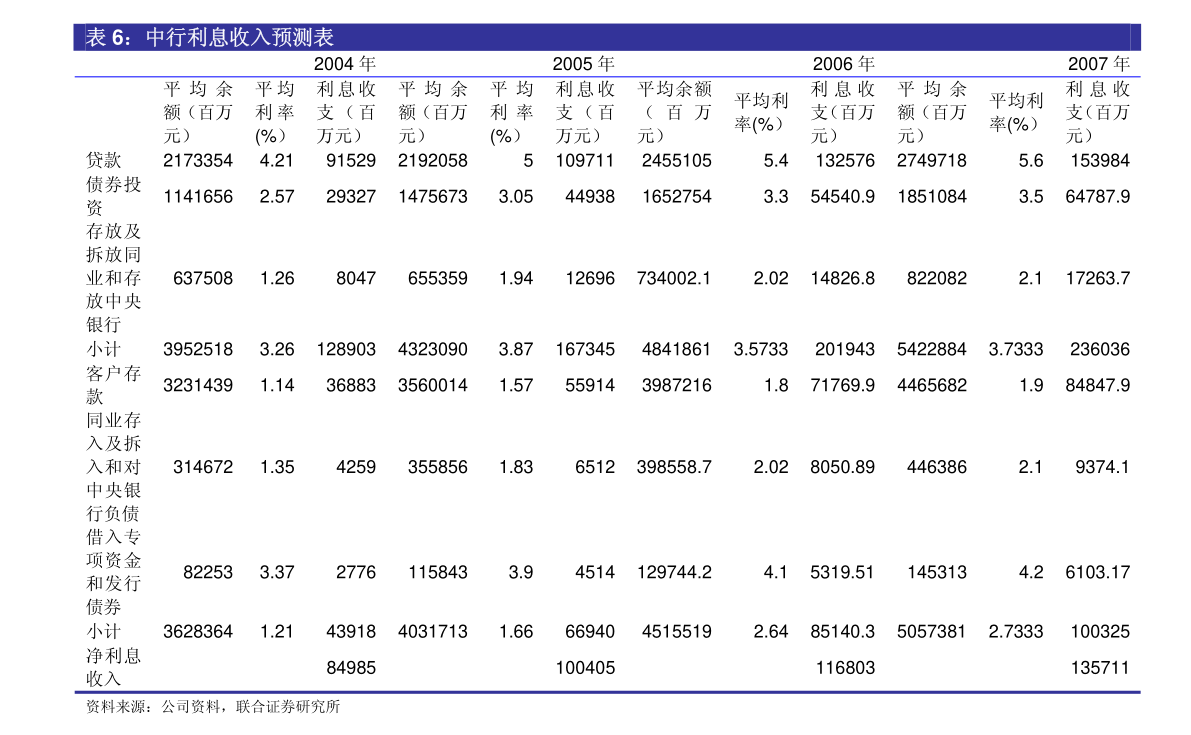
9. 研究结果表明,与安慰剂对比,SHR8058滴眼液可以治疗睑板腺功能障碍相关干眼病,显著改善患者的干眼病症状和体征。
10. 同时,SHR8058滴眼液安全可靠,局部耐受性好,滴药后局部感觉异常发生率与安慰剂相当。
11. 三、药物的其他情况SHR8058滴眼液是公司从NovaliqGmbH公司(以下简称“Novaliq公司”)引进的NOV03(全氟己基辛烷),是一种无色、透明的滴眼液,由100%全氟己基辛烷组成,能迅速扩散至整个眼表,并与泪膜的亲脂部分相互作用,稳定泪膜、防止泪液过度蒸发。

12. 此外,SHR8058滴眼液可穿透睑板腺,与腺体相互作用并溶解腺体中的粘性分泌物,从而达到治疗睑板腺功能障碍相关干眼病的作用。
13. 经查询,除德国Novaliq公司的NovaTears在欧盟和澳大利亚已作为医疗器械上市外,目前无同机制药品上市,暂未查询到NovaTears2021年全球销售数据。
14. 截至目前,SHR8058相关项目累计已投入研发费用约为7,851万元。

15. 四、风险提示药品从研制、临床试验报批到投产的周期长、环节多,药品研发及至上市容易受到一些不确定性因素的影响,敬请广大投资者谨慎决策,注意防范投资风险。
16. 公司将按国家有关规定积极推进上述研发项目,并及时对项目后续进展情况履行信息披露义务。
特此公告。

江苏恒瑞医药股份有限公司董事会2023年2月1日。