主要行业
点击进入可选择细分行业

1. 1香港交易及結算所有限公司以及香港聯合交易所有限公司對本公告內容概不負責,對其準確度或完整性不作任何保證,並且明確聲明不對因依賴本公告的全部或任何部分內容所引起或產生的任何形式的損失承擔責任。
2. SichuanKelun-BiotechBiopharmaceuticalCo.,Ltd.四川科倫博泰生物醫藥股份有限公司(於中華人民共和國註冊成立的股份有限公司)(股份代號:6990)自願公告核心產品蘆康沙妥珠單抗(sac-TMT)於2024年美國癌症研究協會年會上的研究成果四川科倫博泰生物醫藥股份有限公司(「本公司」)董事(「董事」)會(「董事會」)欣然宣佈,本公司將在於2024年4月5日至10日於美國加利福尼亞州聖地牙哥舉行的2024年美國癌症研究協會(AACR)年會上,於當地時間2024年4月9日下午1:30至5:00的壁報展示環節(摘要報告編號:CT247)公佈其抗TROP2ADC蘆康沙妥珠單抗(sac-TMT)(前稱SKB264/MK-2870)用於既往接受過治療的晚期非小細胞肺癌(NSCLC)患者的2期研究的最新療效和安全性結果,並於當地時間下午2:30至4:30的口頭報告環節(摘要報告編號:CT038)以口頭報告的形式公佈其抗TROP2ADC蘆康沙妥珠單抗(sac-TMT)用於既往接受過治療的晚期胃癌或食管胃交界部(GEJ)癌症患者的2期研究的初步療效和安全性結果。

3. 上述研究摘要已於當地時間2024年4月5日發佈於AACR的官方網站上。
4. 研究成果概述如下:非小細胞肺癌既往接受過治療的晚期非小細胞肺癌患者入組並每2週接受一次5mg/kg劑量的蘆康沙妥珠單抗(sac-TMT)治療,直至疾病進展或發生不可耐受毒性(KL264-01,NCT04152499)。
5. 數據截止日期為2023年11月22日(「數據截止日期」)。
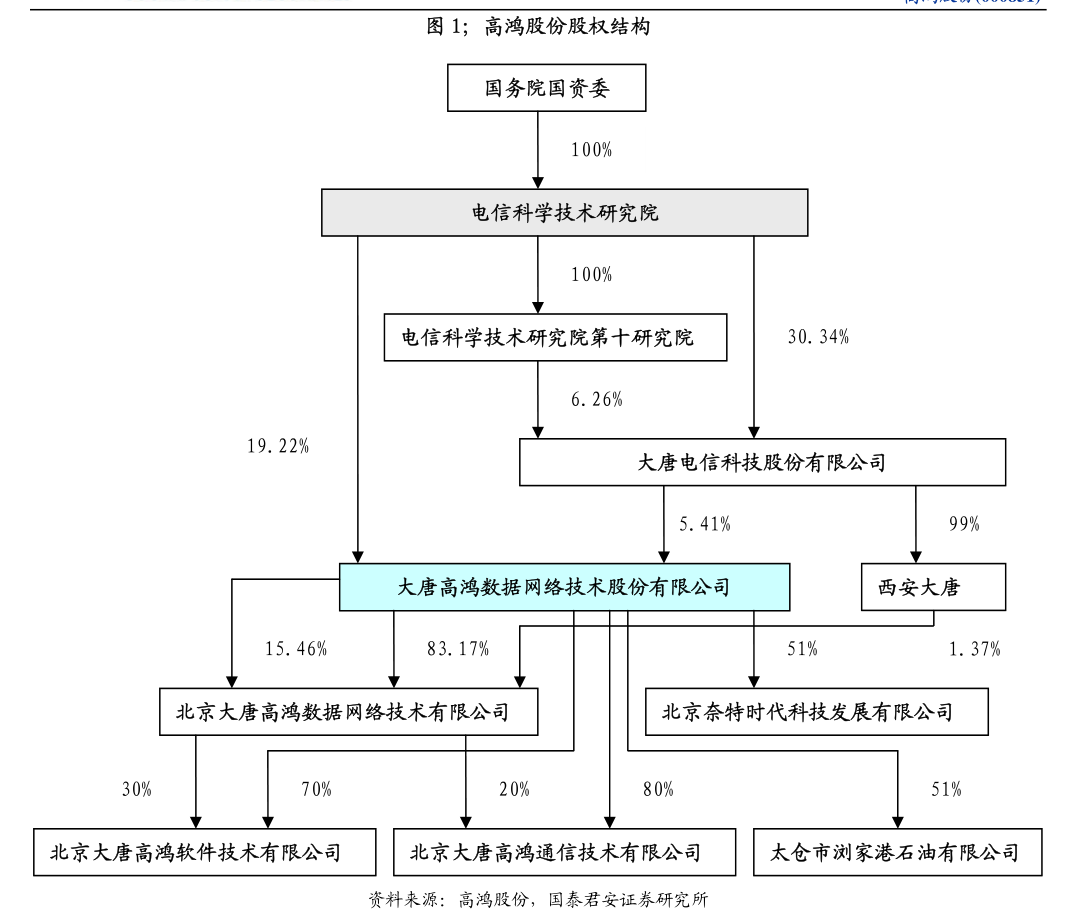
6. 截至數據截止日期,43例非小細胞肺癌患者已入組,中位隨訪時間為17.2個月。
7. 21例EGFR野生型患者既往接受過包括抗PD-1/L1抑制劑在內的中位3線治療方案。

8. 22例EGFR突變患者在接受TKI治療期間或之後病情有所進展,其中50%的患者至少經歷了一線化療失敗。
9. 最新療效結果如下:2總體人群(N=43)EGFR突變(N=22)EGFR野生型總計(N=21)非鱗狀(N=9)鱗狀(N=12)ORR*,%43.6%60.0%26.3%22.2%30.0%中位持續緩解時間,月(95%CI)9.3(3.7,10.3)8.7(3.7,10.3)9.6(3.5,NE)╱╱中位無進展生存期,月(95%CI)7.2(5.4,11.3)11.5(5.7,12.9)5.3(3.5,6.2)5.8(1.5,12.1)5.1(1.9,9.3)中位總生存期,月(95%CI)22.6(13.1,NE)22.7(19.7,NE)14.1(10.7,NE)16.2(5.8,NE)12.8(3.5,NE)12個月總體生存率,%(95%CI)69.0%(52.7,80.7)81.0%(56.9,92.4)57.1%(33.8,74.9)66.7%(28.2,87.8)50.0%(20.8,73.6)18個月總體生存率,%(95%CI)56.5%(40.1,70.0)76.2%(51.9,89.3)35.9%(16.0,56.4)44.4%(13.6,71.9)30.0%(7.7,56.9)*包括已確認或尚未確認緩解。
10. 基於有療效評估的患者(在研究期間進行過至少1次掃描),其中排除了4例患者(2例非鱗狀EGFR突變患者和2例鱗狀EGFR野生型患者)。
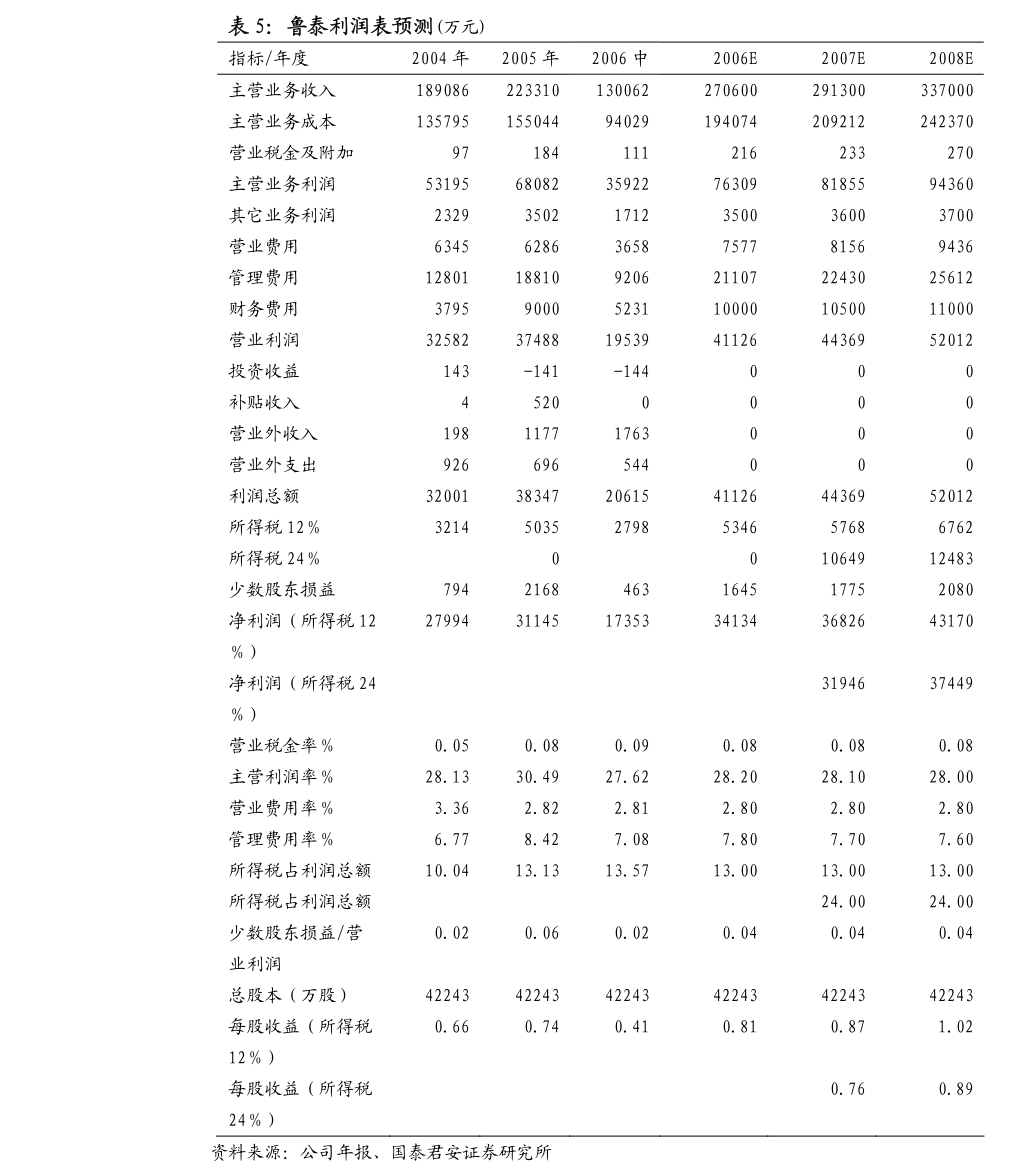
11. 最常見的≥3級治療相關不良事件(TRAE)為中性粒細胞計數降低(34.9%)、貧血(30.2%)、白細胞計數降低(25.6%)、口腔黏膜炎(9.3%)以及皮疹(7.0%)。
12. 未有因TRAE導致的停藥或死亡。
13. 沒有觀察到藥物相關的間質性肺病或肺炎的發生。
14. 目前兩項蘆康沙妥珠單抗(sac-TMT)用於3L+EGFR突變NSCLC患者(NCT06074588)及2LEGFR突變NSCLC患者(NCT06305754)的全球3期研究,以及一項在中國開展的用於2LEGFR突變NSCLC患者的3期研究(NCT05870319)正在進行中。
15. 此外,兩項蘆康沙妥珠單抗(sac-TMT)聯合帕博利珠單抗用於表達程式性死亡配體1(PD-L1)≥50%的轉移性NSCLC患者(NCT06170788)及用於未獲得病理完全緩解的可切除NSCLC患者(NCT06312137)的全球3期研究也正在進行中。
16. 胃癌╱食管胃交界部癌症在KL264-01研究(NCT04152499)的2期擴展隊列中,既往接受過治療的不可手術切除的晚期胃╱食管胃交界部腺癌患者入組並每2週接受一次5mg/kg劑量的蘆康沙妥珠單抗(sac-TMT)單藥治療,直至疾病進展或出現不可耐受毒性。
既往接受過多線治療的胃癌╱食管胃交界部癌症患者首先入組,在隊列標準修訂後入組既往僅接受過一線化療和抗PD-1/L1治療的患者。
數據截止日期為2023年11月22日。
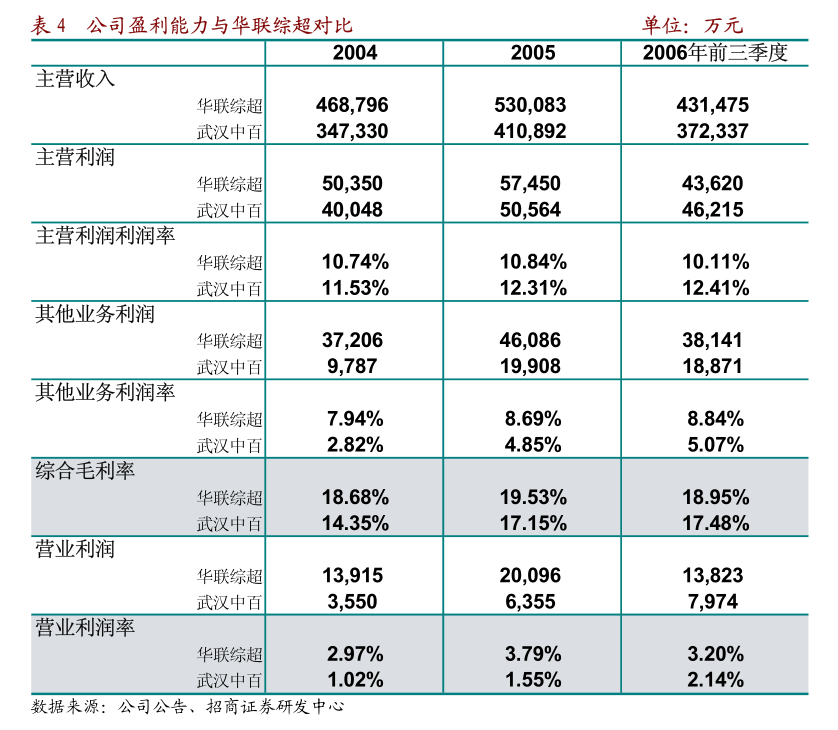
3截至數據截止日期,共有48例患者入組並至少進行了9周的隨訪。
24例患者(50.0%)既往接受過一線治療(2L),另外24例患者(50.0%)既往接受過二線及以上治療(3L+)。
40例患者(83.3%)既往接受過抗PD-1/L1抑制劑治療。
在41例有療效評估的患者(在研究期間進行過至少一次掃描)中,客觀緩解率(ORR)為22.0%(9例部分緩解,2例待確認),疾病控制率(DCR)為80.5%。
2L和3L+患者的客觀緩解率(ORR)分別為27.3%(含2例待確認)和15.8%。
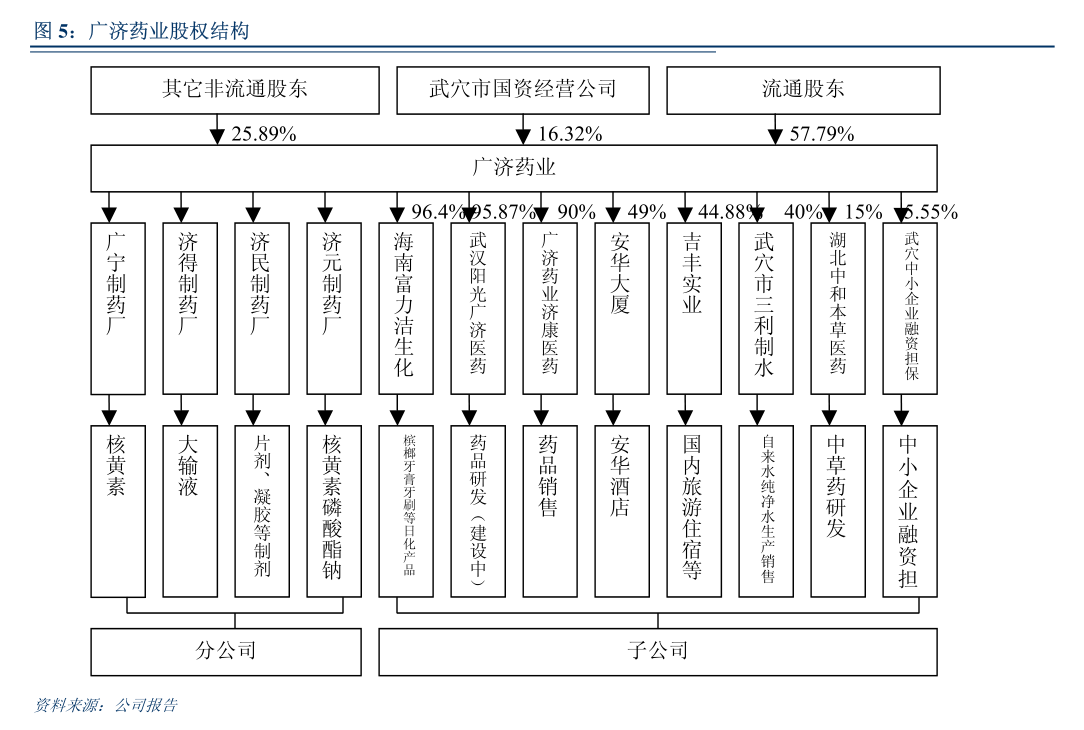
中位持續緩解時間(DoR)為7.5個月。
在隨訪時間較長(中位隨訪時間為14.6個月)的3L+患者(24例患者,其中54.2%既往接受過至少4線治療)中,中位無進展生存期(mPFS)為3.7個月(95%CI:2.6,5.4),中位總生存期(mOS)為7.6個月(95%CI:5.3,15.5)。
最常見的≥3級TRAE為貧血(20.8%)、中性粒細胞計數降低(18.8%)、白細胞計數降低(12.5%)以及中性粒細胞減少症(6.3%)。
未有因TRAE導致的停藥或死亡。
沒有觀察到神經毒性、藥物相關的間質性肺病或非感染性肺炎的發生。
目前正在計劃開展一項蘆康沙妥珠單抗(sac-TMT)單藥治療對比標準治療(SOC)化療用於3L+胃癌或食管胃交界部腺癌患者的全球3期研究。
風險警告蘆康沙妥珠單抗(sac-TMT)最終不一定能夠成功開發及商業化。
本公司股東及潛在投資者於買賣本公司證券時務請審慎行事。
承董事會命四川科倫博泰生物醫藥股份有限公司董事長兼非執行董事劉革新香港,2024年4月8日於本公告日期,董事會包括董事長兼非執行董事劉革新先生;執行董事葛均友博士及王晶翼博士;非執行董事劉思川先生、馮昊先生、曾學波先生及李東方先生;及獨立非執行董事鄭強博士、涂文偉博士、金錦萍博士及李越冬博士。

正在加载,请稍候...