
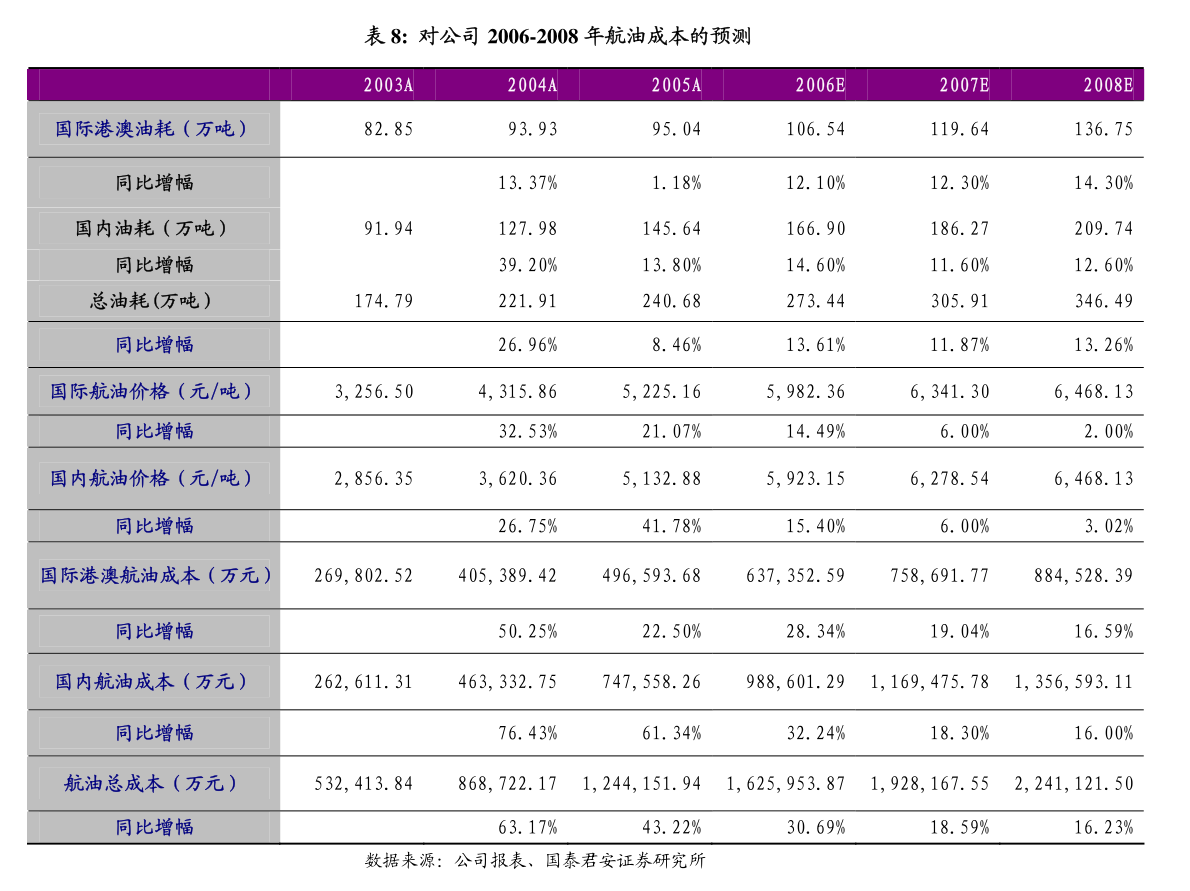
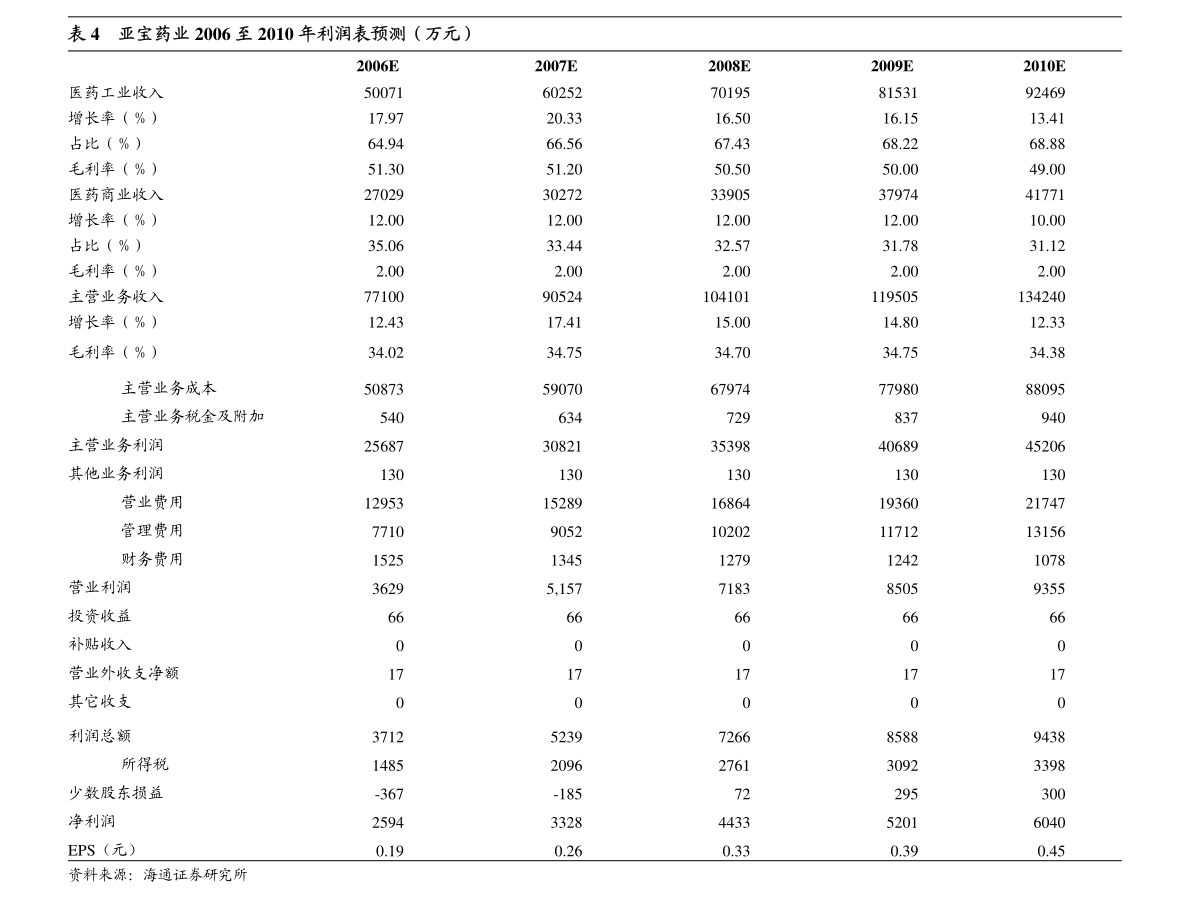
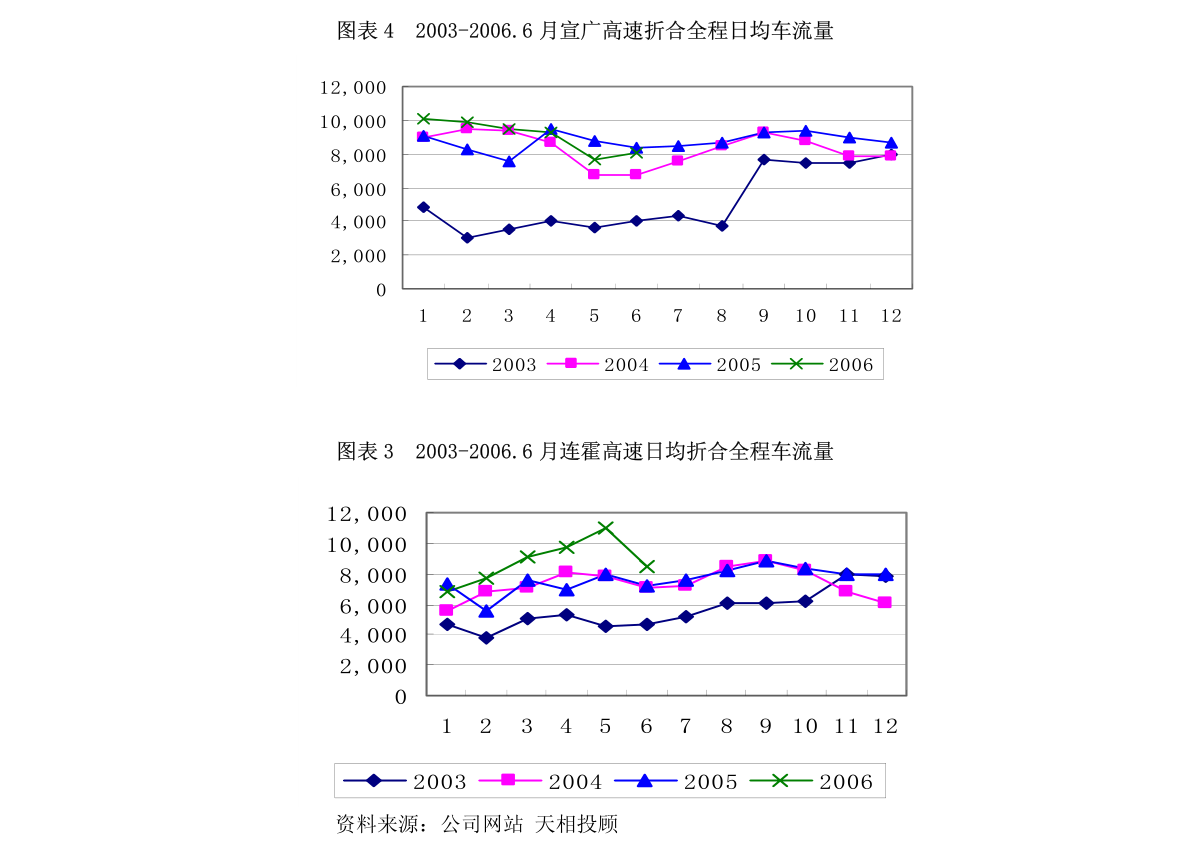
1. 香港交易及結算所有限公司及香港聯合交易所有限公司對本公告之內容概不負責,對其準確性或完整性亦不發表任何聲明,並明確表示,概不對因本公告全部或任何部分內容而產生或因倚賴該等內容而引致的任何損失承擔任何責任。
2. SHANGHAIJUNSHIBIOSCIENCESCO.,LTD.*上海君實生物醫藥科技股份有限公司(於中華人民共和國註冊成立的股份有限公司)(股份代號:1877)海外監管公告本公告乃根據香港聯合交易所有限公司證券上市規則第13.10B條規則作出。
3. 茲載列上海君實生物醫藥科技股份有限公司在上海證券交易所網站刊發之《上海君實生物醫藥科技股份有限公司自願披露關於VV116獲得國家藥品監督管理局附條件批准上市的公告》,僅供參閱。
4. 承董事會命上海君實生物醫藥科技股份有限公司熊俊先生主席中國,上海,2023年1月30日於本公告日期,本公司董事會包括執行董事熊俊先生、李寧博士、馮輝博士、張卓兵先生、姚盛博士、李聰先生及鄒建軍博士;非執行董事武海博士及湯毅先生;以及獨立非執行董事陳列平博士、RoyStevenHerbst博士、錢智先生、張淳先生及馮曉源博士。
5. *僅供識別之用证券代码:688180证券简称:君实生物公告编号:临2023-006上上海海君君实实生生物物医医药药科科技技股股份份有有限限公公司司自自愿愿披披露露关关于于VV116获获得得国国家家药药品品监监督督管管理理局局附附条条件件批批准准上上市市的的公公告告2023年1月28日,国家药品监督管理局(以下简称“国家药监局”)根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准上海君实生物医药科技股份有限公司(以下简称“公司”)控股子公司上海旺实生物医药科技有限公司(以下简称“旺实生物”)申报的口服核苷类抗新型冠状病毒(SARS-CoV-2)1类创新药氢溴酸氘瑞米德韦片(商品名:民得维,产品代号:VV116/JT001,以下简称“VV116”)上市(国药准字H20230002),用于治疗轻中度新型冠状病毒感染(以下简称“COVID-19”)的成年患者。
6. VV116由中国科学院上海药物研究所、中国科学院武汉病毒研究所、中国科学院新疆理化技术研究所、中国科学院中亚药物研发中心/中乌医药科技城(科技部“一带一路”联合实验室)、临港实验室、苏州旺山旺水生物医药有限公司(以下简称“旺山旺水”)和公司共同研发。

7. 由于药品获得上市批准后的商业化容易受到一些不确定性因素的影响,敬请广大投资者谨慎决策,注意防范投资风险。
8. 现将相关情况公告如下:一一、、药药品品相相关关情情况况VV116是一款新型口服核苷类抗病毒药物,能够以核苷三磷酸形式非共价结合到新冠病毒RNA依赖性RNA聚合酶(以下简称“RdRp”)的活性中心,直接抑制病毒RdRp的活性,阻断病毒的复制,从而发挥抗病毒的作用。
9. 临床前研究显示,VV116对包括奥密克戎在内的新冠病毒原始株和突变株表现出显著的抗病毒作用,且无遗传毒性。
10. 2021年9月,公司控股子公司上海君拓生物医药科技有限公司与旺山旺水本公司董事会及全体董事保证本公告内容不存在任何虚假记载、误导性陈述或者重大遗漏,并对其内容的真实性、准确性和完整性依法承担法律责任。
11. 订立合作开发合同,共同承担VV116在合作区域内的临床开发和产业化工作,合作区域为除中亚五国1、俄罗斯、北非2、中东3四个区域外的全球范围。
12. 2021年12月,VV116在乌兹别克斯坦获得批准用于治疗中/重度COVID-19患者。
13. 本次获批主要基于一项多中心、双盲、随机、安慰剂对照、III期临床研究(NCT05582629),旨在评价VV116在伴或不伴有进展为重症高风险因素的轻中度COVID-19患者中的有效性和安全性,由浙江大学传染病诊治国家重点实验室主任李兰娟院士担任主要研究者。
14. 研究的主要终点是从首次给药至持续临床症状消失的时间,次要终点包括至持续临床症状缓解时间、截至第28天发生疾病进展的患者比例、SARS-CoV-2核酸和病毒载量的变化、安全性等。

15. 研究结果显示,至期中分析的数据截止日,在1,277例随机并接受治疗的受试者中,VV116相较安慰剂,主要终点从首次给药至持续临床症状消失(11项COVID-19相关临床症状评分=0且持续2天)时间显著缩短,中位时间差达2天;至持续临床症状缓解时间显著缩短,病毒载量较基线变化等病毒学指标均优于安慰剂组。
16. 二二、、风风险险提提示示(一)医药产品具有高科技、高风险、高附加值的特点,且药品获得上市批准后的商业化也容易受到一些不确定性因素的影响。
(二)该药品为附条件批准,公司及控股子公司旺实生物将在规定期限内严格按照附条件的要求完成相应的研究工作并及时提交相关材料。
(三)受到全球疫情发展及控制情况、相关预防性疫苗的普及、治疗性药物的陆续获批、后续产品市场推广等多种因素影响,未来该药品的商业化推广也具有不确定性。
公司将积极推进上述研发项目,并严格按照有关规定及时对项目后续进展情况履行信息披露义务,敬请广大投资者谨慎决策,注意防范投资风险。
有关公司信息以公司指定披露媒体《中国证券报》《上海证券报》《证券时报》《证券日报》以及上海证券交易所网站刊登的公告为准。
特此公告。
1中亚五国:指哈萨克斯坦、乌兹别克斯坦、吉尔吉斯斯坦、塔吉克斯坦、土库曼斯坦。

2北非:指埃及、利比亚、突尼斯、阿尔及利亚、摩洛哥、苏丹。
3中东:指沙特阿拉伯、伊朗、伊拉克、科威特、阿联酋、阿曼、卡塔尔、巴林、土耳其、以色列、巴勒斯坦、叙利亚、黎巴嫩、约旦、也门、塞浦路斯、格鲁吉亚、亚美尼亚、阿塞拜疆。
上海君实生物医药科技股份有限公司董事会2023年1月30日。










