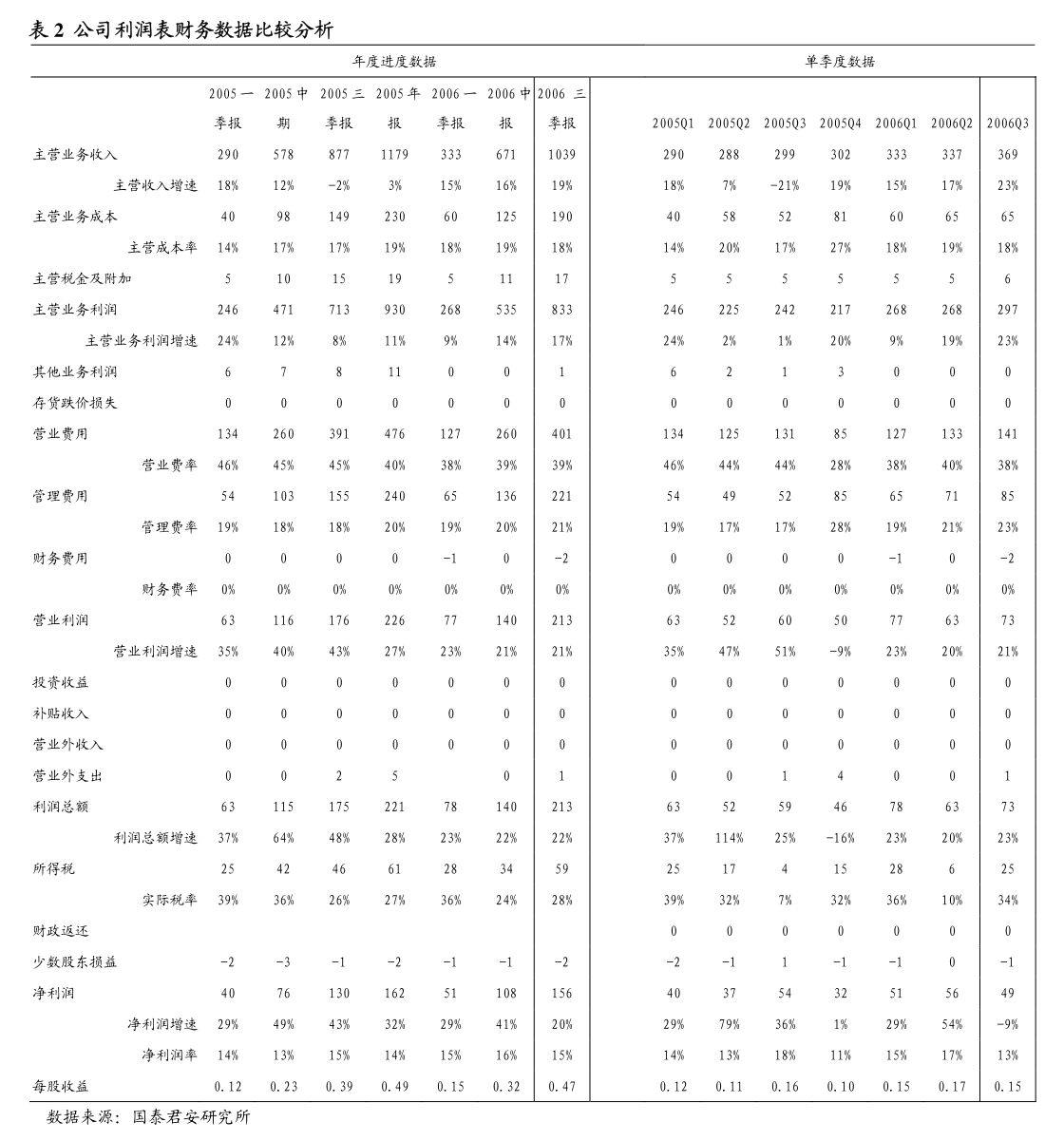
1. 证券代码:000963证券简称:华东医药公告编号:2010-006证券代码:000963证券简称:华东医药公告编号:2024-044华东医药股份有限公司关于全资子公司收到药品注册受理通知书的公告本公司及董事会全体成员保证信息披露的内容真实、准确、完整,没有虚假记载、误导性陈述或重大遗漏。
2. 2024年5月11日,华东医药股份有限公司(以下简称“公司”)全资子公司杭州中美华东制药有限公司(以下简称“中美华东”)收到国家药品监督管理局(NMPA)签发的《受理通知书》(受理号:CXHS2400040、CXHS2400041),由中美华东作为申请人申报的迈华替尼片(迈瑞东,MifanertinibTablets)用于表皮生长因子受体(EGFR)21号外显子L858R置换突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗的上市许可申请获得受理。

3. 现将有关详情公告如下:一、该药物基本信息内容产品名称:迈华替尼片申请事项:境内生产药品注册上市许可注册分类:化学药品1类规格:按C21H19ClF3N5O2计(1)45mg;(2)60mg受理号:CXHS2400040、CXHS2400041申报适应症:用于EGFR21号外显子L858R置换突变的局部晚期或转移性NSCLC成人患者的一线治疗。
4. 申请人:杭州中美华东制药有限公司结论:根据《中华人民共和国行政许可法》第三十二条的规定,经审查,决定予以受理。
5. 二、该药物研发及注册情况迈华替尼片为一款新型、强效、高选择性、具有口服活性的不可逆EGFR/人表皮生长因子受体-2(HER2)小分子抑制剂,是全新的、拥有自主知识产权的国家1类创新药。
6. 迈华替尼通过与EGFR(ErbB1)和HER2(ErbB2)的激酶区域共价结合,不可逆地抑制酪氨酸激酶自磷酸化,导致ErbB信号下调,从而抑制肿瘤生长。

7. 2015年,中美华东与苏州迈泰生物技术有限公司和杭州华东医药集团新药研究院有限公司签订协议,取得迈华替尼原料药及其制剂在中国市场的权益,并在约定区域内进行产品新药技术开发和商业化的权利(详见公司披露于巨潮资讯网的相关公告,公告编号:2015-057)。
8. 2014年10月,迈华替尼片用于治疗晚期恶性实体瘤的临床试验申请获得NMPA批准。
9. 2023年5月,国家药品监督管理局药品审评中心(CDE)将迈华替尼片用于EGFR罕见突变(S768I,L861Q和G719X)的晚期NSCLC患者的一线治疗纳入突破性治疗药物程序(详见公司披露于巨潮资讯网的相关公告,公告编号:2023-036)。
10. 本次迈华替尼片的上市申请是基于一项Ⅲ期注册临床试验(登记号:CTR20192297),即一项迈华替尼对比吉非替尼一线治疗EGFR敏感突变的晚期非鳞非小细胞肺癌的随机、平行、双盲双模拟、多中心的Ⅲ期研究。
11. 目前,该项Ⅲ期临床研究主要终点结果达到方案预设的优效标准,并于近日递交迈华替尼片用于EGFR21号外显子L858R置换突变的局部晚期或转移性NSCLC成人患者的一线治疗的上市许可申请获受理。
12. 截至目前,公司在迈华替尼片项目【含用于EGFR罕见突变(S768I,L861Q和G719X)的晚期NSCLC患者的一线治疗和用于EGFR敏感突变的晚期非鳞非小细胞肺癌的一线治疗】的直接研发投入约为27,860万元。
13. 三、对上市公司的影响及风险提示肺癌是全球发病率和死亡率最高的恶性肿瘤之一,其中NSCLC是最常见的病理类型。
14. 据统计,2020年我国新诊断的肺癌约82.0万,死亡病例约71.5万。
15. NSCLC约占原发性肺癌的85%,其中肺腺癌是NSCLC中最主要的病理亚型,中国人群中约50%的肺腺癌患者存在EGFR突变。
16. 19号外显子缺失突变及21号外显子L858R置换突变是EGFR突变中的最常见的突变类型(>70%),其中21号外显子L858R置换突变占30-40%。
目前,已有多款EGFR-TKI在中国获批上市用于21号外显子L858R置换突变NSCLC的一线治疗。
三代EGFR-TKI在21号外显子L858R置换突变人群中的疗效不及19号外显子缺失突变人群,既往对照一代和/或二代EGFR-TKI研究中均未观察到总生存期(OS)获益、部分研究甚至提示OS获益受损;而已上市二代EGFR-TKI由于耐受性不佳限制了临床应用。
因此,21号外显子L858R置换突变NSCLC的治疗存在未满足的临床需求。
迈华替尼片有望成为安全、耐受且高效的一线治疗方案,为患者提供新的治疗选择。
公司将全力推进这款产品在中国的注册上市,为相关患者提供临床获益更优的治疗选择,争取早日惠及广大患者。
根据国家药品注册相关的法律法规要求,上述药品在获国家药品监督管理局上市许可申请受理后将由国家药品监督管理局药品审评中心进行审评,由国家药品监督管理局审批通过后颁发药品注册证书方可上市销售。
药品审评审批时间、审批结果及未来产品市场竞争形势均存在诸多不确定性,公司将按照国家有关规定,积极推进药物研发及注册进度,并根据研发进展情况及时履行信息披露义务,敬请广大投资者注意投资风险。
特此公告。
华东医药股份有限公司董事会2024年5月12日。