
1. 1香港交易及結算所有限公司及香港聯合交易所有限公司對本公告的內容概不負責,對其準確性或完整性亦不發表任何聲明,並明確表示概不會就本公告全部或任何部分內容而產生或因倚賴該等內容而引致的任何損失承擔任何責任。
2. BriiBiosciencesLimited騰盛博藥生物科技有限公司(於開曼群島註冊成立的有限公司)(股份代號:2137)自願性公告業務更新本公告乃由騰盛博藥生物科技有限公司(「本公司」)董事會(「董事會」)自願作出。
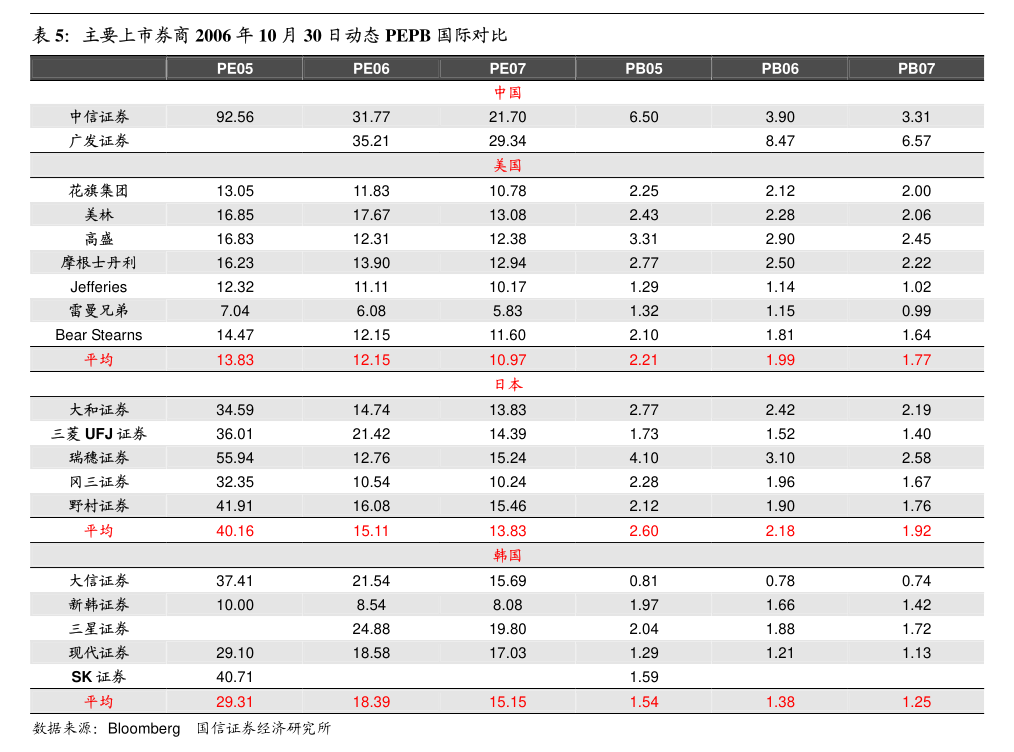
3. 董事會欣然宣佈中國國家藥品監督管理局藥品審評中心將在研的乙型肝炎病毒(「HBV」)特異性廣譜中和單克隆抗體BRII-877(tobevibart)和在研的HBV靶向小干擾核糖核酸BRII-835(elebsiran)納入突破性治療品種。
4. 這是繼2023年11月基於重組蛋白的HBV免疫療法BRII-179獲得突破性治療品種認定之後,本公司在尋求HBV功能性治癒方面取得的又一個里程碑。
5. BRII-877(tobevibart)獲得突破性治療品種認定是基於由VirBiotechnology,Inc.(「Vir」)及本公司開展的1期和2期研究。
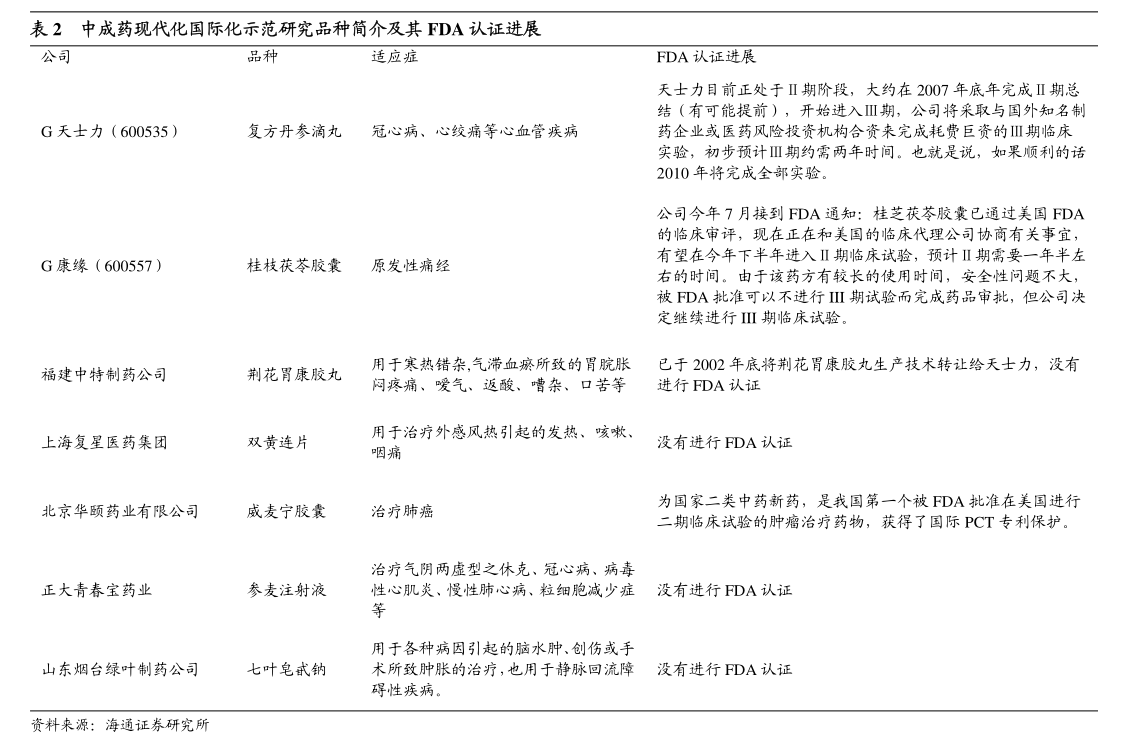
6. 截至2023年9月底,有超過350名患者接受了BRII-877(tobevibart)的治療。
7. 數據顯示,BRII-877(tobevibart)具有良好的耐受性,並能顯著降低乙肝表面抗原水平,這表明BRII-877(tobevibart)有潛力成為慢性HBV感染者和慢性丁型肝炎病毒(「HDV」)感染者治療方案的重要組成部分。
8. BRII-835(elebsiran)獲得突破性治療品種認定是基於由本公司及其合作夥伴Vir開展的1期和2期研究。
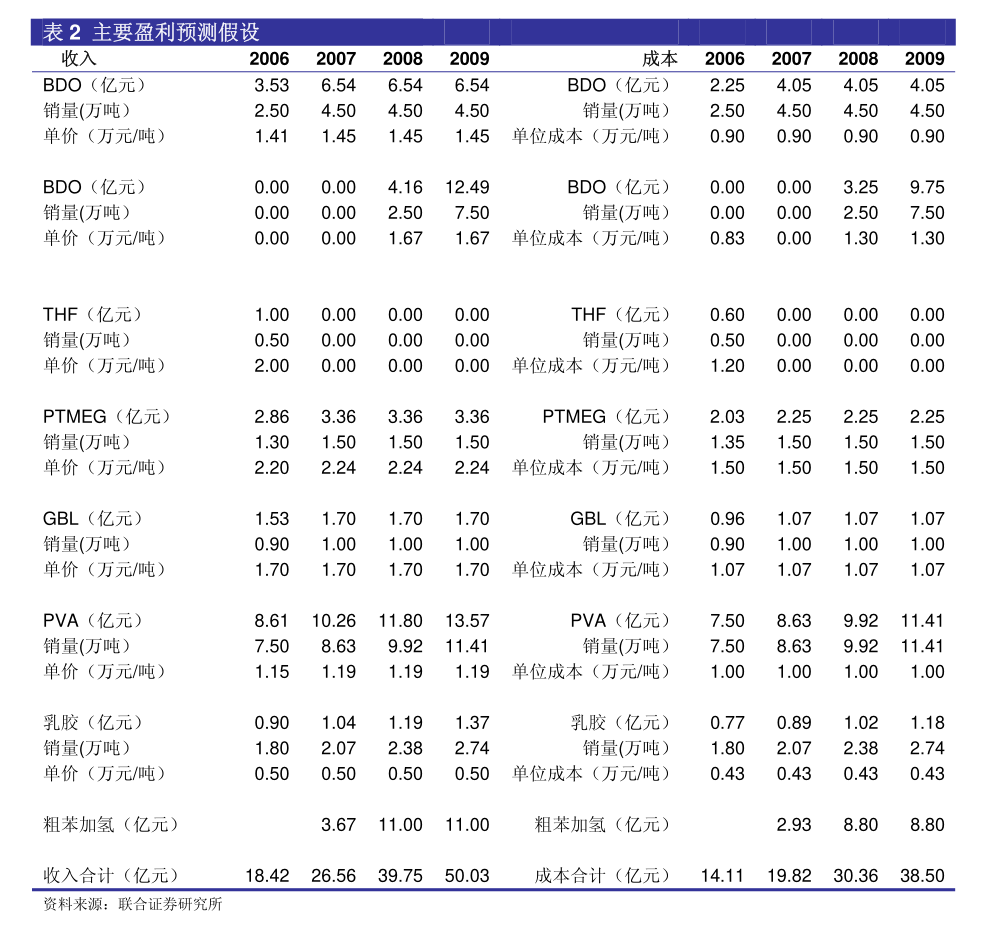
9. 截至2023年9月底,已有超過570例HBV感染者參加了臨床研究,這些研究結果表明BRII-835(elebsiran)具有良好的耐受性,並在慢性HBV和慢性HDV受試者中顯示出直接抗病毒的活性。
10. 2本公司中國研發負責人朱青博士表示:「BRII-835和BRII-877獲得突破性治療品種認定,以及BRII-179早前獲得突破性治療品種認定,進一步支持了我們長期以來為慢性HBV感染患者開發功能性治癒聯合療法的科學依據。
11. 在過去的五年中,本公司和我們的合作夥伴Vir進行了大量的臨床試驗,我們從中獲得了非常全面的臨床安全性和有效性數據,並對我們的後期開發計劃,以及在更廣泛的患者群體中實現更高的HBV功能性治癒率有了透徹的認識。

12. 」擁有三種突破性治療手段,使本公司在應對更廣泛的HBV感染(包括合併HDV感染)方面處於獨特的地位。
13. 作為本公司開發HBV功能性治癒療法的一部分,本公司及其合作夥伴Vir正在推進於2024年啟動多項聯合研究的計劃,以進一步優化治療方案,為本公司的註冊戰略提供依據,從而為HBV患者提供最佳治療方案。
14. 提示聲明:概無確保本公司將能最終成功開發或上市銷售BRII-179、BRII-835或BRII-877療法。

15. 本公司股東及潛在投資者在買賣本公司股份時務請審慎行事。
16. 如有疑問,本公司股東及潛在投資者務請諮詢專業顧問或財務顧問的建議。
承董事會命騰盛博藥生物科技有限公司主席ZhiHong博士香港,2024年5月14日於本公告日期,董事會包括執行董事ZhiHong博士及李安康博士;非執行董事RobertTaylorNelsen先生;以及獨立非執行董事MartinJMurphyJr博士、GraceHuiTang女士、徐耀華先生、GreggHuberAlton先生及楊台瑩博士。










