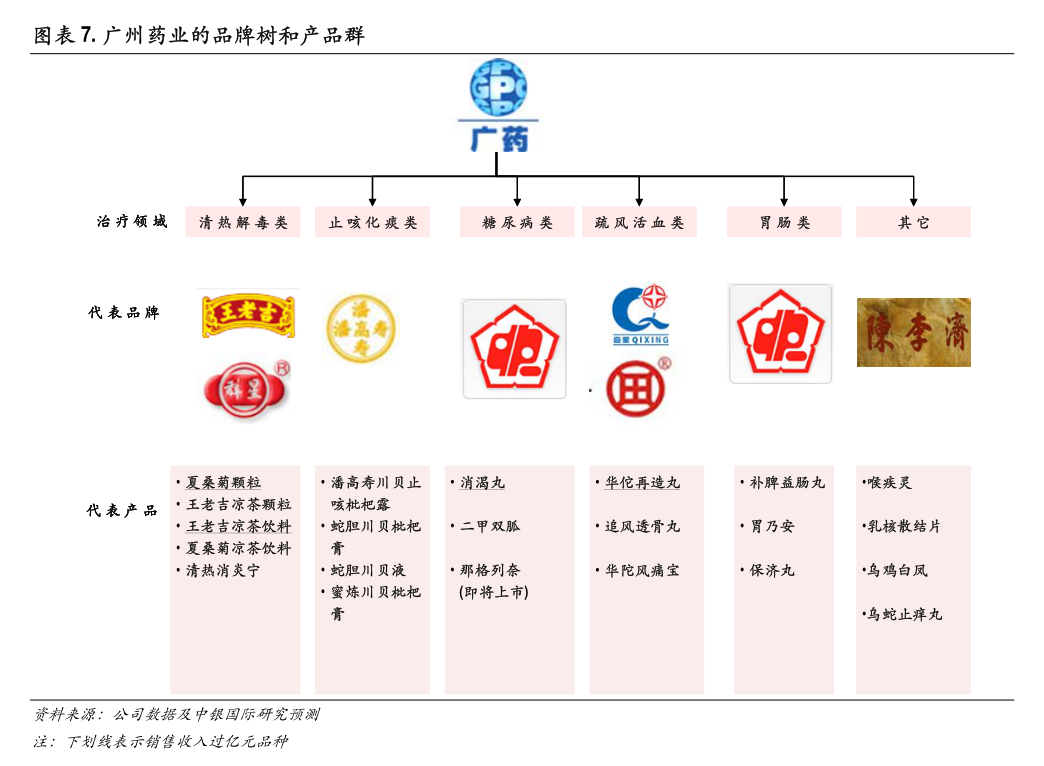
1. 证券代码:300396证券简称:迪瑞医疗公告编号:2015-059证券代码:300396证券简称:迪瑞医疗公告编号:2024-029迪瑞医疗科技股份有限公司关于公司产品获得IVDRCE认证的公告迪瑞医疗科技股份有限公司(以下简称“公司”)11项医疗器械产品于近日取得了IVDRCE认证,具体情况如下:序号产品名称分类有效期临床用途1全自动样品处理系统(LA-60SE)ClassA长期用于检测前/后样本的离心等,进行分析前后的处理及加工。
2. 2全自动样品处理系统(LA-90)ClassA长期用于检测前/后样本的离心、分杯(分注)、冷藏等,进行分析前后的处理及加工。

3. 3糖类抗原19-9测定试剂盒(化学发光免疫分析法)ClassC有效期至2029.04.09用于检测肿瘤标记物,作为癌症的辅助信息使用。
4. 4性激素结合球蛋白测定试剂盒(化学发光免疫分析法)ClassB有效期至2029.04.09主要用于多种雄激素异常疾病的辅助诊断。
5. 5甲胎蛋白测定试剂盒(化学发光免疫分析法)ClassC有效期至2029.04.09用于检测肿瘤标记物,作为癌症的辅助信息使用。

6. 6游离三碘甲状腺原氨酸测定试剂盒(化学发光免疫分析法)ClassB有效期至2029.04.09用于甲状腺功能的辅助诊断。
7. 7载脂蛋白A1测定试剂盒(免疫比浊法)ClassB有效期至2029.04.09用于评价心血管疾病、血脂异常性疾病风险。
8. 本公司及董事会全体成员保证信息披露的内容真实、准确、完整,没有虚假记载、误导性陈述或重大遗漏。

9. 欧盟体外诊断医疗器械法规(IVDR,EU2017/746)将替代欧盟体外诊断医疗器械指令(IVDD,98/79/EC)对欧盟市场的体外诊断医疗器械进行管理。
10. 欧盟质量管理体系IVDR认证证书的获得,标志着公司成为符合欧盟体外诊断医疗器械法规认证要求的医疗器械制造商,为公司后续的欧盟认证切换工作奠定了坚实的基础。
11. 根据欧盟体外诊断医疗器械法规的规定,上述产品已经具备进入欧盟市场的必要条件,将进一步增强了公司产品的综合竞争力,对公司未来的经营将产生积极影响。

12. 上述产品实际销售情况取决于未来市场推广效果,公司目前尚无法预测其对公司未来业绩的影响,敬请投资者注意投资风险。
13. 特此公告。
14. 迪瑞医疗科技股份有限公司董事会2024年05月15日8C反应蛋白试剂盒(胶乳免疫比浊法)ClassB有效期至2029.04.09用于细菌性感染和病毒性感染的辅助鉴别诊断。
15. 9丙氨酸氨基转移酶测定试剂盒(丙氨酸底物法)ClassB有效期至2029.04.09用于检测肝功能,主要用于肝脏疾病的诊断。
16. 10纤维蛋白原测定试剂盒(凝固法)ClassC有效期至2029.04.09主要用于弥散性血管内凝血、原发性纤溶症的辅助诊断。
11H10尿液分析试纸条ClassB有效期至2029.04.09用于肾功能异常等情况的辅助诊断以及普通人群的健康筛查。